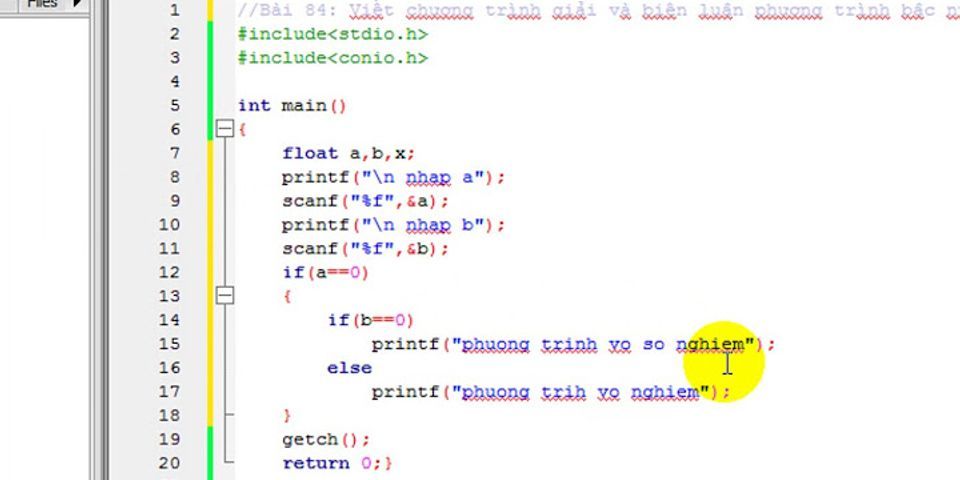
* The preview only display some random pages of manuals. You can download full content via the form below.
The preview is being generated... Please wait a moment! ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 1) I. Phần trắc nghiệm: Câu 1: Cho phản ứng: Mg + H2SO4 → MgSO4 + H2S + H2O. Tồng hệ số cân bằng là: A. 18 B. 19 C. 20 D. 16 Câu 2. Cho Al + H2SO4 → Al2(SO4)3 + SO2 + H2O. Tổng hệ số các chất tham gia phản ứng là: A. 6 B. 8 C. 4 D. 10 Câu 3. Cho 11,2 gam Fe + HNO3 thu được khí X có thể tích 13,44 lít. Khí X là: A. N2 B. NO2 C. NO D. N2O Câu 4. Cho 9,6 gam Mg tác dụng với H2SO4 thu được 0,1 mol khí X. Khí X là: A. S B. SO2 C. H2S D. SO3 Câu 5. Cho 5,4 gam Al tác dụng với H 2SO4 đặc, nóng thoát ra 6,72 lít khí X ( đktc) . Tổng hệ số cân bằng của phản ứng là: A. 18 B. 20 C. 11 D. 18 Câu 6. Cho Al + HNO3 thu được hỗn hợp hai khí N2 và NO tỉ lệ mol 1:1. Tổng hệ số cân bằng của HNO3 A. 63 B, 104 C.102 D. 98 Câu 7. Cho Zn tác dụng với HNO 3 thu được hỗn hợp gồm N 2O và NO theo tỉ lệ thể tích là 2:3. Tổng hệ số của phản ứng là: A. 62 B., 58 C. 64 D. 80 Câu 8. Cho m gam Zn tác dụng với HNO3 thu được 6,72 lít khí N2O. m có giá trị là: A. 16,5 B. 7,8 C. 13,5 D. 26.5 Câu 9. Cho m gam Al tác dụng với H2SO4 thu được 13.44 lit khí H2S . m có giá trị là: A. 32.2 B. 43.2 C. 44.2 D. 65.2 Câu 10. Cho 19.2 gam Cu tác dụng với HNO 3 được V lít khí NO. Khối lượng của dung dịch sau phản ứng tăng hau giảm bao nhiêu gam: A. tăng 13.2 gam B. giảm 13.2 gam C. tăng 19,2 gam D. không thay đổi. Câu 11. Cho 8,3 gam Al và Fe tác dụng với HNO 3 thu được 13.44 lít khí NO2 ( đktc). Xác định %Al trong hỗn hợp. A. 35.5% B. 32.53% C. 67.17% D. 56.15% Câu 12. Cho 7,8 gam hỗn hợp gồm Al và Mg tác dụng với H 2SO4 thu được 8,96 lít khí SO2 ( đktc). Tỉ lệ khối lượng của Al và Mg là A. 9/3 B. 9/4 C. 27/24 D. 54/19 Câu 13. Cho hỗn hợp m gam Al và Cu ( có tỉ lệ mol tương ứng là 1:2) tác dụng với HNO 3 thu được 1.568 lít khí N2 . Giá trị m là? A. 13,2 B. 15.5 C. 16.8 D.16.5 Câu 14. Cho MnO2 + HCl → MnCl2 + Cl2 + H2O. Số phân tử HCl đóng vai trò môi trường: A. 1 B. 4 C.2 D. 3 Câu 15. Cho Mg + HNO3 → Mg(NO3)2 + N2 + H2O. Tỉ lệ số phân tử HNO3 đóng vai trò môi trường và bị khử là: A. 5:1 B. 1:5 C. 12:5 D. 12:5 Câu 16. Mg + H2SO4 → MgSO4 + S + H2O. Tìm số phân tử H2SO4 bị khử và môi trường. A. 3, 8 B. 2,7 C. 1,3 D. 2,5 Câu 18. P + HNO3 + H2O → H3PO4 + NO. Số phân tử HNO3bị khử và môi trường là” A. 5,0 B. 4,0 C. 6,5 D. 6,4 Câu 19. Cho 5,4 gam Al tác dụng với HNO3 thoát ra khí NO2 . Tính số mol HNO3 đóng vai trò môi trường: A. 0,6 B. 0,2 C. 0,8 D. 0,5 Câu 20. Sơ đồ nào sau đây viết sai: A. Al → Al3+ + 3e B. Fe3+ +1e → Fe2+ C/ O2 + 2e → 2O2D. Cl2 + 2e → 2Cl3+ Câu 21. Cho Al → Al + 3e. Đi từ 13,5 gam Al . sẽ có bao nhiêu mol e được tách ra. A. 0.5 B. 0.25 C. 1.5 D. 1.7 Câu 22. sơ đồ nào sau đây biểu diễn quá trinh oxi hóa. A. N2 + 6e → 2N3B. Fe2+ → Fe3+ + 1e + C. Na + Cl → NaCl D. NaOH + HCl → NaCl + H2O Câu 23. Cho 5,4 gam Al tác dụng H2SO4 đặc thu được 6,72 lít khí X ( đktc). Tổng hệ số cân bằng là: A. 12 B. 18 C. 19 D. 20 Câu 24. Cho phản ứng: P + HNO3 + H2O → H3PO4 + NO. Chất bị oxi hóa là: A. P B. HNO3 C. H2O D. H3PO4 Câu 25. Cho m gam Al , Cu tỉ lệ mol 1:1 + HNO 3 thu được 11,2 lít khí NO. Giá trị m là: A. 29,3 gam B. 27.3 gam C. 27,1 gam D. 25,6 gam Câu 26. Trong phân tử CO2 có bao nhiêu liên kết pi. A. 4 B. 2 C. 1 D. 3 Câu 27. Cho 21.9 gam Al và Cu tác dụng với HNO 3 thu được 6,72 lít khí NO. Tỉ lệ mol của Al và Cu là: A. 1:3 B. 3:1 C/ 2:1 D. 1:2 Câu 28. Cho 0.13 mol Al tác dụng với HNO3 thu được V lít khí N2 va NO theo tỉ lệ mol 1:1 Giá trị của V là: A. 0.448 lít B. 1.344 lít C. 0.672 lít D. 0.884 lít + 22-. Câu 29.Sắp xếp số e trong các ion sau theo thử tự tăng dần.NH 4 , SO3 , CO3 A. NH4+ < SO32- < CO32B. NH4+ < CO32- < SO3222+ C. SO3 < CO3 < NH4 D. CO32-< NH4+ < SO32Câu 30. Cho m gam hỗn hợp Al, Fe, Cu tác dụng với O 2 thu được 19,6 gam chất rắn. Hóa tan hết 19,6 gam chát rắn cần 100 ml dung dịch HCl 12M. Tính m? A. 10 gam B. 19.6 gam C. 18.2 gam D. 24 gam Câu 31. Cho nguyên tử X có tổng e ở phân lớp s = 7. X thuộc nhóm A. Cho biết X là nguyên tố nào: A. Na B. K C. O D. S Câu 32. Cho các chất sau đây: CO2, CH4, N2, HCl, H2O, O2. Số chất không có sự phân cực. A. 3 B. 2 C. 4 D. 5 2+ 6 Câu 33. Cho X có cấu hình e: [ Ar] 3d . Tìm vị trí của X: ……………………………… Câu 34. X có hai đồng vị có số khối 13 và 11. Có % đồng vị bằng nhau. 0,25 mol X có khôi lượng: A. 3 B. 12 C/ 4 D. 6 Câu 35. Cho phản ứng : Na + Cl2 → 2NaCl ∆ H = -882,2 kj Đây là phản ứng: A. Thu nhiệt B. tỏa nhiệt. C. không thu nhiệt. D. trao đổi. Câu 36. X , Y nằm cùng một chu kì, 2 nhóm liên tiếp có tổng e bằng 25. Tính số mol của e nhương đi từ 0,1 mol X và 0.2 mol Y. A. 0.6 B.0,8 C. 0.7 D. 0.5 Câu 37. Nguyên tố X có công thức oxit cao nhất là: RO 2/ Trong đó trong hợp chất khí với H %R bằng 75%. Xác định số cặp e liên kết và chưa liên kết trong oxit cai nhất. A. 4,2 B. 2,0 C. 4,0 D. 2,4 Câu 38. Cho 32 gam hỗn hợp Al, Fe, Zn tác dụng vừa đủ với V lít dung dịch HCl 0,5M thu được 44,2 gam muối. Giá trị V : A. 0.2 lít B. 0.4 lít C. 0.8 lít D. số khác. Câu 39. X và Y là hai kim loại kiềm có khối luộng 10,1 gam tác dụng hết nước thoát ra 3,36 lít khí ( đktc). Xác định lệ mol X và Y. ( MX < MY) A. 2:3 B. 1:2 C. 2:1 D/ 1:1 Câu 40. Nguyên tố X nằm chu kì 3, nhóm VIA. X thuộc nguyên tố nào sau đây: A. s B, p C. f D. d II. Phần tự luận: Câu 1: Cân bằng; a. FeCl2 + K2Cr2O7 + HCl -> FeCl3 + KCl + CrCl3 + H2O b. KMnO4 + FeSO4 + H2O → K2SO4 + MnO2 + Fe2(SO4)3 +Fe(OH)3 Câu 2. Cho 4.4 gam hỗn hợp 2 kim loại thuộc nhóm IIA và ở 2 chu kỳ liên tiếp vào dung dịch HCl dư thu được dung dịch X và 3,36 lít H2(đkc) a)Xác định tên 2 kim loại và tính %khối lượng hỗn hợp của chúng trong hỗn hợp ban đầu . b)Nếu ban đầu khối lượng đã dùng 200 gam HCl .Tính nồng độ %của các muối trong dung dịch X. Câu 3. Hỗn hợp gồm Al và Mg có khối lượng là 3.54 gam được chia thành hai phần bằng nhau: + Phần 1: cho tác dụng với HCl dư thu được 1.904 lít khí H2( dktc). + Phần 2: Hòa tan trong HNO3 loãng dư thu được hỗn hợp khí gồm NO và N2O có tỉ lệ mol là 1:2. Tính thế tích từng khí NO và N2O ở điều kiện tiêu chuẩn. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 2) I. Phần trắc nghiệm: Câu 1. Hoà tan m gam Al vào dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,03mol N 2O và 0,01 mol NO . Giá trị m là A. 8,1 gam B. 13,5 gam C. 2,43 gam D. 1,35 gam Câu 2. Hßa tan hoµn toµn 10,2gam hçn hîp X gåm hai kim lo¹i Al, Mg b»ng dung dÞch HCl dư thu ®îc 11,2 lÝt khÝ H2 (®ktc). C« c¹n dung dÞch sau ph¶n øng thu ®ưîc lưîng muèi khan lµ A. 45,7 gam B. 44,2 gam C. 25,2 gam D. 41,5 gam. Câu 3: Cho 2g một kim loại nhóm IIA tác dụng với dd HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây: A. Be B. Ba C. Ca D. Mg Câu 4: Cho 3,9g K tác dụng với 101,8g H2O. C% của dung dịch thu được A. kết quả khác B. 5,3 C. 5,5 D. 4,8 Câu 5:Hoà tan m gam Al vào dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,03mol N 2O và 0,01 mol NO . Giá trị m là A. 8,1 gam B. 13,5 gam C. 2,43 gam D. 1,35 gam Câu 6. Cho phương trình phản ứng hóa học sau đây: Al + HNO 3 Al(NO3)3 + NH4NO3 + H2O. Tổng hệ số nguyên đơn giản nhất của phương trình phản ứng hóa học trên là: A. 58 B. 64 C. 62 D. 46 Câu 7: Cho phản ứng hoá học : Al + HNO3 → Al(NO3)3 + NO2 + H2O Số phân tử HNO3 bị Al khử và số phân tử HNO3 tạo muối nitrat trong phản ứng là : A. 3 và 3. B. 3 và 2. C. 1 và 3. D. 4 và 3. Câu 8. Hòa tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml dung dịch H2SO4 0,1M (vừa đủ). Sau phản ứng, hỗn hợp muối khan thu được sau khi cô cạn dung dịch có khối lượng là (g): A. 5,81. B. 6,81. C. 3,81. D. 4,81. Câu 9. Trong 3 oxit FeO, Fe2O3, Fe3O4, chaát naøo taùc duïng vôùi HNO3 kh«ng cho ra khí: A. Chæ coù Fe3O4. B. FeO. C. Chæ coù Fe2O3. D. FeO vaø Fe3O4. Câu 10. Hßa tan 2,16 gam FeO trong lîng dung dÞch HNO3 lo·ng thu ®ưîc V lÝt (®ktc) khi NO duy nhÊt. V b»ng: A. 0,224 lÝt. B. 0,336 lÝt. C. 0,448 lÝt D. 2,240 lÝt. Câu 11. Cho 2,52 g một kim loại tác dụng hết với dung dịch H 2SO4 loãng, thu được 6,84 g muối sunfat. Kim loại đó là: A. Zn. B. Al. C. Fe. D. Mg. Câu 12. Hỗn hợp A gồm FeO, Fe3O4, Fe2O3. Trong hỗn hợp A, mỗi oxit đều có 0,05 mol. Khối lượng của hỗn hợp A là: A. 232 g. B. 23.2 g. C. 233 g. D. 234 g. Câu 13. Cho 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột tác dụng hoàn toàn với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,73 gam. Thể tích dung dịch HCl 2M vừa đủ để phản ứng hết với Y là: A. 20 ml. B. 50 ml. C. 100 ml. D. 90 ml. Caâu 14. Coù bao nhieâu phaûn öùng oxi hoùa khöû trong caùc phaûn öùng cho sau ñaây: 1. CaO + CO2 CO2. 2. CuO + CO Cu + CO2. 3. Fe(OH)2 + O2 + H2O Fe(OH)3. 4. NaAlO2 + CO2 + H2O Al(OH)3 + NaHCO3. 5. NH3 + H2SO4 (NH4)2SO4. 6. NaHSO4 + NaHCO3 Na2SO4 + CO2 + H2O. 7. FeCl3 + KI FeCl2 + KCl + I2. 8. FeCl3 + SnCl2 FeCl2 + SnCl4. A. 3 B. 4 C. 5 D.6 Câu 15: Tỉ lệ số phân tử HNO3 đóng vai trò là chất oxi hoá và môi trường trong phản ứng: FeO + HNO3 Fe(NO3)3 + NO + H2O là bao nhiêu? A. 1 : 3 B. 1 : 10 C. 1 : 9 D. 1 : 2 Câu 16: Cho phản ứng sau: FeS + H2SO4 Fe2(SO4)3 + SO2 + H2O. Hệ số cân bằng tối giản của H2SO4 là : A. 4 B. 12 C. 10 D. 8 Câu 17: Trong phản ứng hoá học sau : 3K2MnO4 + 2H2O 2KMnO4 + MnO2 + 4KOH. Nguyên tố man gan : A.Chỉ bi oxi hoá B.Chỉ bị khử C.Vừa bị oxi hoá , vừa bị khử D.Không bị oxi hoá , không bị khử Câu 18: Trong các phản ứng phân huỷ dưới đây phản ứng nào không phải là phản ứng oxi hoá khử : A. 2KMnO4 K2MnO4 + MnO2 + O2 B. 2Fe(OH)3 Fe2O3 + 3H2O to C. (NH4)2Cr2O7 N2 + Cr2O3 + 4H2O D. 2KClO3 2KCl + 3O2 Câu 19: Cho phản ứng hoá học sau : SO 2 + Cl2 +2H2O H2SO4 + 2HCl . Câu nào sau đây diễn tả đúng tính chất của các chất phản ứng : A.SO2 là chất oxi hoá , Cl2 là chất khử B.SO2 là chất khử , H2O là chất oxi hoá C.Cl2 là chất oxi hoá , H2O là chất khử D.Cl2 là chất oxi hoá , SO2 là chất khử Câu 20:Cho phản ứng sau : FeS + HNO3 Fe(NO3)3 + NO + H2SO4 + H2O .Tổng hệ số cân bằng tối giản là số nguyên của các chất bằng : A.13 B.14 C.15 D.16 II. Phần tự luận: Câu 1. Cân bằng phương trình phản ưng hóa học sau đây theo phương pháp cân bằng electron: a. KHSO4 + KMnO4 + FeSO4 → K2SO4 + MnSO4 + Fe2(SO4)3 + H2O. b. Al + HNO3 → Al(NO3)3 + N2O + N2 + H2O ( tỉ lệ mol N2O : N2 = 2:3) Câu 2. Hoàn thành sơ đồ phản ứng hóa học sau đây: KMnO4 → Cl2 → KClO3 → Cl2 → FeCl3 → FeCl2 → NaCl → NaOH → NaClO Câu 3. A là kim loại hóa trị n. Hòa tan 1.62 gam A Trong HCl dư thoát ra 2.016 lít khí H 2 ( đktc). B là kim loại hóa trị M . Hòa tan 2,24 gam kim loại B trong dung dịch HNO3 thì thu được 896 ml khí NO. a. Xác định hai kim loại A và B. b. Hỗn hợp X gồm hai kim loại A và B. Cho hỗn hợp X có khối lượng 3.61 gam cho tác dụng với V ml dung dịch H2SO4 0,1M và HCl 0,18M thì phản ứng vừa đủ và thoát ra 2.128 lít khí H 2 ( đktc) và dung dịch Y. Cô cạn dung dịch Y thu được b gam hỗn hợp muối. - Tính khối lượng từng kim loại trong hỗn hợp ban đầu. - Tính V dung dịch HCl? - Tính b? Câu 4. Hỗn hợp A gồm Clo và Oxi : Cho hỗn hợp A phản ứng hết với hỗn hợp gồm 4,8 gam Mg và 8,1 gam Al tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của hai kim loại. Xác định % theo khối lượng và % theo thể tích của Cl 2 và O2 trong hỗn hợp ban đầu. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 3) I. Phần trắc nghiệm: Câu 1: Cho các phương trình phản ứng sau : a)SO2 + Cl2 + 2H2O H2SO4 +2 HCl b) 2NO2+ 2NaOH NaNO2 + NaNO3 + H2O c)CO2 + NaOH NaHCO3 d)Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O e)3Fe3O4 +28HNO3 9Fe(NO3)3+NO + 14H2O f) Fe2O3 + 6HNO3 2Fe(NO3)3 + 3H2O g)AgNO3 + Fe(NO3)2 Fe(NO3)3 + Ag h)C2H6 + Cl2 C2H5Cl + HCl i)CH3CH2OH + CuO CH3CHO + Cu + H2O k)Fe + 2Fe(NO3)3 3Fe(NO3)2 . Số phản ứng oxi hoá khử là : A.6 B. 7 C.8 D.9 Câu 2: Trong phản ứng : Cl2 + 2KOH KCl + KClO + H2O A. Cl2 Vừa là chất oxi hoá, vừa là chất khử. B. Cl2 Không là chất oxi hoá, không là chất khử. C. Cl2 Chỉ là chất oxi hoá . D. Cl2 Chỉ là chất khử Câu 3: Hãy chọn phản ứng mà SO2 có tính oxi hoá : A. 5SO2 + 2KMnO4 + 2H2O K2SO4 + 2MnSO4 + 2H2SO4 B. SO2 + Na2O Na2SO3 C. SO2 + 2H2O + Br2 2HBr + H2SO4 D. SO2 + 2H2S 3S + 2H2O Câu 4: Cho phản ứng hoá học: Fe + CuSO4 FeSO4 + Cu. Trong phản ứng này đã xảy ra: 2+ A. Sự oxi hoá Fe và sự oxi hoá Cu. B. Sự khử Fe và sự oxi hoá Cu. 2+ 2+ 2+ C. Sự khử Fe và sự khử Cu D. Sự oxi hoá Fe và sự khử Cu Câu 5: Cho các phương trình hoá học : a)SO2 + 2H2O + Br2 2HBr + H2SO4 b)SO2 + H2O ⇄ H2SO3 c)5SO2 + 2KMnO4 + 2H2O K2SO4 +2MnSO4+2H2SO4 d)SO2 + 2H2S 3S + 2H2O e)2SO2 + O2 ⇄ 2SO3 . SO2 đều là chất khử trong các phản ứng hoá học : A. a , b, c, d , e B.a , d , e C.a , d , c , e D.a , c , e Câu 6 . Cho phản ứng cháy CuFeS2 tạo ra sản phẩm là CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ: A. nhận 12 electron. B. Nhận 13 electron. C. nhường 12 electron. D. nhường 13 electron. Câu 7: Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3 loãng, dư thu được 0,448 lít khí NO duy nhất (đktc). Giá trị m là A. 1,12 B. 5,6 C. 0,56 D. 11,2 Câu 8: Cho 40g hỗn hợp ZnO, FeO, Fe 2O3, Fe3O4, MgO tác dụng hết với 200ml dung dịch HCl 0,5M (vừa đủ) thu được dung dịch X. Khối lượng muối có trong X là A. 43,65 g. B. 50,90 g. C. 42,75 g. D. Kết quả khác. Câu 9: Cho 4,875 g một kim loại M hóa trị II tác dụng hết với dung dịch HNO 3 loãng thu được 1,12 lit khí NO duy nhất (đktc). Kim loại M là: A. Mg B. Zn C. Ni D. Cu Câu 10. Cho 2,52 g một kim loại tác dụng hết với dung dịch H2SO4 loãng thu được 6,84 g muối sunfat. Kim loại đó là: A. Mg B. Zn C. Fe D. Al Câu 11. Phân tử nào sau đây mà số cặp electron chưa tham gia liên kết là 4: A. HCl B. N2 C. CO2 D. H2O. 65 63 Câu 12. Đồng có 2 đồng vị bền 29 Cu và 29 Cu . Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm số nguyên tử của đồng vị đồng có số khối 63. A. 27% B. 73% C. 26,5% D. 73.5% Câu 13. Nguyên tử nguyên tố X có số thứ tự là 19 trong bảng tuần hoàn, công thức phân tử của X với oxi và hiđro lần lượt là: A. XO và XH2. B. XO và XH. C. X2O và XH. D. X2O và XH2. Câu 14. Nguyên tố Y là phi kim thuộc chu kì 3 của bảng tuần hoàn, Y tạo được hợp chất khí với hiđro và công thức oxit cao nhất là YO3. Nguyên tố Y tạo với kim loại M cho hợp chất có công thức MY 2, trong đó M chiếm 46,67% về khối lượng. M là: A. Mg (24) B. Fe (56) C. Cu (64) D. Zn (65). Câu 15. Cho các nguyên tố X(Z=12), Y(Z=11), M(Z=14), N (Z=13). Tính kim loại được sắp xếp theo thứ tự giảm dần là: A. Y > X > M > N. B. M > N > Y > X. C. M > N > X > Y. D. Y > X > N > M. Câu 16. Tổng số hạt (p, n, e) của nguyên tử một nguyên tố thuộc nhóm VIIA là 28. Nguyên tử khối của nguyên tử này là: A. 19. B. 21. C. 18. D. 20. Câu 17. Nguyên tử nguyên tố R có tổng số các loại hạt là 180. Số hạt mang điện nhiều hơn số hạt không mang điện là 32. Số nơtron của R là : A. 53. B. 75. C. 74. D. 70. Câu 18. Tổng số electron trong nhóm ion nào PO43– ; SiO32– ; ClO4– ; SO42– đều chứa 50 electron ? A. PO43– ; SiO32– ; SO42–. B. PO43– ; SiO32– ; ClO4–. 2– – 2– C. SiO3 ; ClO4 ; SO4 . D. PO43– ; ClO4– ; SO42–. Câu 19. Dãy chất nào dưới đây được xếp theo chiều tăng dần sự phân cực liên kết trong phân tử? A. KCl, HCl, Cl2. B. Cl2, KCl , HCl. C. HCl, Cl2, KCl. D. Cl2, HCl, KCl. Câu 20. Kim loại A có khối lượng 2.352 gam tác dụng với Oxi tạo ra oxit có khối lượng 3.248 gam oxit. Kim loại A là: A. Al B. Fe C. Cu D. Mg I. Phần tự luận: * Nguyên tử: Câu 1. XO2- có tổng số hạt là 89. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 29. Xác định nguyên tố X. ( Biết trong O có số hạt mang điện gấp đôi số hạt không mang điện). Câu 2. Nguyên tử X của nguyên tố R có tổng số hạt cơ bản là 46. Số hạt không mang điện bằng 8/15 số hạt mang điện. a) Xác định tên R. b) Y là đồng vị của X. Y có ít hơn X là 1 nơtron và Y chiếm 4% về số ngtử của R. Tính ngtử lượng trung bình của R. Câu 3. Nguyên tố Cl trong tự nhiên là một hh gồm hai đồng vị 35Cl và 37Cl .Nguyên tử khối trung bình của Clo là 35,5.Tính phần trăm về khối lượng của 35Cl trong muối kaliclorat KClO3 . Câu 4. Tổng số hạt proton, nơtron và electron trong nguyên tử của nguyên tố Y là 28. Trong đó hạt không mang điện chiếm khoảng 35%. Hãy xác định cấu tạo hạt nhân ( số proton và nơtron), số khối A, viết cấu hình electron và gọi tên nguyên tố Y. * Bảng tuần hoàn: Câu 5. Để hòa tan hoàn toàn 1,16 g một hidroxit kim loại R hoá trị II cần dùng 1,46 g HCl. Xác định tên kim loại R, viết công thức hidroxit. Câu 6. X là nguyên tố thuộc phân nhóm chính nhóm VII. Oxit cao nhất của nó có phân tử khối là 272 đvC. a) Xác định tên X. b) Y là kim loại hóa trị II. Cho 10,08 lít khí X (đkc) tác dụng Y thu được 90 g muối. Tìm tên Y. Câu 7. Cho 3 g hỗn hợp X gồm một kim loại kiềm A và natri tác dụng với nước dư thu được dung dịch Y và khí Z. Để trung hoà dung dịch Y cần 0,2 mol HCl. Xác định nguyên tố A . Câu 8. Oxit của R có dạng ROx có %O = a. Hợp chất khí với hidro của R có %H = b. Tỉ lệ giữa a và b bằng 10:2 Xác định R? Câu 9. Một hợp chất của Cacbon là hidro có khối lượng riêng là 2.4107 gam/lít. %H trong hợp chất là 11,11%. Tìm công thức của hợp chất. * Oxi hóa khử: Câu 10. Cho một thanh đồng vào 50 ml dd AgNO 3 .Sau một thời gian lấy thanh đồng ra sấy khô cân lại thấy nặng hơn trước 2,28 g. a) Viết phương trình pư. Biểu diền các quá trình khử , oxi hóa. b) Tính lượng Ag sinh ra và nồng độ Cu(NO3)2 trong dd nhận được. Câu 11. Hòa tan m gam Zn bằng dd HNO 3 0,25M (vừa đủ) thu được 0,03 mol NO và 0,02 mol NO 2 và dd chứa x gam muối. a) Viết phương trình pư và các quá trình khử , oxi hóa xảy ra. b) Tính giá trị của m và x. c) Tính thể tích dd HNO3 0,25M cần dùng. Câu 12. Hỗn hợp gồm hơi S và Cl 2 có thể tích là 2.912 lít ( đktc) có tỉ khối hơi so với hidro là 28. Cho hỗn hợp tác dụng với K và Mg thu được hỗn hợp muối có khối lượng là 13.64 gam. Tính % theo khối lượng của kim loại có trong hỗn hợp ban đầu. Câu 13. Cho 0,48 gam Mg và 1.215 gam Al tác dụng với dung dịch HNO 3 dư thu được hỗn hợp khí X gồm 336ml khí NO và 364 ml khí Y. ( Là một trong các khí có thể cho sau đây: NO, N2O, NO2, N2). Xác định công thức của khí Y. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 4) I. Phần trắc nghiệm: Câu 1. Cho quá trình : Fe→ Fe3+ + 3e. Quá trình trên là quá trình : A. quá trình khử. B. quá trình oxi hoá .C. quá trình nhận e. D. quá trình trao đổi. Câu 2. Cho 6C, 16S, 11Na, 12Mg. Dãy có chiều giảm tính bazơ và tăng tính axit của các oxit là: A. Na2O , MgO , CO2 , SO3. B. MgO , Na2O , SO3 , CO2. C. Na2O , MgO , SO3 , CO2. D. MgO , Na2O , CO2 , SO3. Câu 3. Cho dãy các chất sau đây: NH4Cl, NaCl, MgO, NH3, CO2, NH4NO3, SCl4. Số chất có liên kết ion trong phân tử là: A. 1 B. 2 C. 3 D. 4 Câu 4. Cho 5.2 g bột kẽm vào 100ml dung dịch CuCl2 0,75M. Lắc kỹ cho đến khi kết thúc phản ứng. Xác định số mol của các chất trong dung dịch thu được. Á. 4.8 gam. B. 5.125 gam C. 0.325 gam. D. Kết quả khác. Câu 5. Tinh thế nào sau đây thuộc loại tinh thể phân tử: A. Kim cương. B. NaCl. C. Nước đá. D. CuCl2 Câu 6. Góc liên kết của hai chất nào sau đây có độ lớn bằng nhau: A. NH3 và H2O. B. CH4 và CO2 C. H2O và CH4 D. C2H2 và H2S Câu 7. Cho phản ứng hóa học: Cl2 + KOH → KCl + KClO3 + H2O Tỉ lệ giữa số nguyên tử clo đóng vai trò chất oxi hóa và số nguyên tử clo đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là A. 3 : 1. B. 1 : 3. C. 5 : 1. D. 1 : 5. Câu 8. Cho các phản ứng sau, ở phản ứng nào NH3 không đóng vai trò chất khử ? A. 4NH4 + 5O2 → 4NO + 6H2O B. 2NH3 + 3Cl2 → N2 + 6HCl C. 2NH3 + 3CuO → 3Cu + N2 + 3H2O D. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4 Câu 9. Đốt cháy hoàn toàn hỗn hợp FeS , FeS 2 , CuS2 , Cu2S với tỉ lệ mol như nhau và có tổng khối lượng là 9.92 gam thì tổng số mol electron đã nhường là: A. 0.72 mol B. 0.58 mol C. 0.84 mol D. Số khác. Câu 10. Dãy chất nào cho dưới đây có phân tử đều là phân tử không phân cực? A. N2, CO2, Cl2, H2. B. N2, l2, H2, HCl. C. N2, HI, Cl2, CH4. D. Cl2, SO2. N2, F2 Câu 11.Cho 0,2 mol oxit của nguyên tố R thuộc nhóm III A tác dụng với dung dịch axit HCl dư thu được 53,4g muối khan. R là A. Al. B. B. C. Br. D. Ca. Câu 12.Cho 6,4g hỗn hợp hai kim loại thuộc hai chu kỳ liên tiếp, cùng nhóm IIA tác dụng hết với dung dịch HCl dư thu được 4,48 l khí hiđro (đktc). Các kim loại đó là A. Be và Mg B. Mg và Ca C. Ca và Sr D. Sr và Ba Câu 13. Ñeå m gam boät saét ngoaøi khoâng khí moät thôøi gian thu ñöôïc 6 gam hoãn hôïp caùc chaát raén . Hoaø tan hoaøn toaøn hoãn hôïp ñoù baèng dung dòch HNO 3 loaõng thu ñöôïc 1,12 lít khí NO duy nhaát (ñktc) và muối Fe(NO3)3. Tìm m? A. 5.04 gam B. 4.48 gam C. 5.6 gam D. 8.4 gam. Câu 14.Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. Nguyên tố R và vị trí của nó trong bảng HTTH là A. Na ở ô 11, chu kỳ III, nhóm IA. B. Mg ở ô 12, chu kỳ III, nhóm IIA. C. F ở ô 9, chu kỳ II, nhóm VIIA. D. Ne ở ô 10, chu kỳ II, nhóm VIIIA. Câu 15: Cho 1 gam kim loại Al tác dụng với 1 gam khí Cl2 sẽ tạo ra m gam muối AlCl3. Giá trị của m là A. 1g B. 2g C. 1,253g D. 6,892g Câu 16. Hòa tan m g Fe vào dung dịch HNO3 loãng, dư thu được 0,448 lít khí NO duy nhất (đktc). Giá trị của m là: A. 0,56 g B. 1,12 g C. 11,2 g D. 5,60 g Câu 17. Hòa tan hoàn toàn hỗn hợp gồm 0,6 mol Ag và 0,3 mol Cu vào dung dịch axit HNO 3 dư, được 8,96 lít khí Y duy nhất (đktc). Chất khí Y là: A. NO2 B. N2 C. N2O D. NO Câu 18: Cho kim loại A có hoá trị II tác dụng đủ với dung dịch HCl, sau phản ứng thu được 44,45 gam muối và 7,84 lit khí ở ĐKTC. Kim loại A là A.Zn. B.Mg. C.Fe. D.Ca. Câu 19: Cho 64 gam hỗn hợp gồm CuO, MgO, Fe 2O3 tác dụng vừa đủ với 600 ml dung dịch H 2SO4 2M. Khối lượng muối thu được là A.120 gam. B.160 gam. C. 170 gam. D. 180 gam. Câu 20. Cho 0.972 gam Al tác dụng với H 2SO4 đặc thì thu được 0.3024 lít khí X. Phản ứng hóa học tổng hệ số của các chất tham gia phản ứng là: .A. 19 B. 23 C. 42 D. 45 II. Phần tự luận: Câu 1: Nguyên tử nguyên tố X có tổng số hạt bằng 40, trong đó số n và số p khác nhau không quá 1 đơn vị. a) Tính số khối, số p, n, e và viết kí hiệu X? b) Viết cấu hình e và xác định vị trí của X trong bảng tuần hoàn. Câu 2. Cho 2,24g sắt tác dụng với dung dịch HCl dư. Khí sinh ra cho qua ống đựng 4,2g CuO được đun nóng. Xác định khối lượng của chất rắn ở trong ống sau phản ứng. Câu 3. Hòa tan m gam Fe bằng dd HNO 3 dư theo ptpư : Fe + HNO 3 → Fe(NO3)3 + N2 + H2O , thu được 6,72 lit khí N 2 (ở đktc) và dd chứa x gam muối. a) Cân bằng phương trình , viết quá trình khử , oxi hóa xảy ra. b) Tính giá trị của m và x. c) Tính thể tích dd HNO3 1,5 M cần dùng. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 5) I. Phần trắc nghiệm: Câu 1. Cho phản ứng HCl + K2Cr2O7 → KCl + CrCl3 + Cl2 + H2O. Số phân tử HCl đóng vai trò môi trường là : A. 14 B. 8 C. 12 D. 6 Câu 2. Cho một phi kim R nằm ở nhóm chính x ( x lẻ) trong bảng hệ thống tuần hoàn: Hợp chất khí với Hiđrô và Oxit cao nhất của R có dạng là: A. RH(8-x), R2Ox.B. RHx, RO(8-x). C. RH(8-x), ROx/2. D. RHx , R2Ox. 3+ 5 2+ Câu 3. X có cấu hình electron ở phân lớp ngoài cùng là 3d . Y có tồng số electron là 28. X và Y cách nhau bao nhiêu nguyên tố. A. 2 B. 3 C. 4 D. 5 Câu 4. Để hòa tan 16.8 gam hỗn hợp hai kim loại X, Y thì cần 1 mol HCl. Để hòa tan 33.6 gam hỗn hợp kim loại đó thì đã dùng bao nhiêu lít dung dịch HCl ( 0.5M) . biết đã dùng dư 25% so với lượng cần phản ứng. Thể tích dung dịch HCl đã dùng là : A. 4 lít B. 5 lít C. 2.5 lít D. 2 lít Câu 5. Cho 19.2 gam kim loại hóa trị II tác dụng với dung dịch HNO 3 dư thu được khí NO, sau phản ứng khối lượng dung dịch tăng thêm 13.2 gam. Kim loại ban đầu là : A. Al B. Fe C. Cu D. Mg Câu 6. Cho m gam hỗn hợp Al và Mg có tỉ lệ mol Al : mol Mg = 2 :1 tác dụng với dung dịch H2SO4 đặc nóng thu được 4.48 lít khí H2S. Tính m ? A. 15.6 gam B. 14 gam C. 15,2 gam D. Số khác. Câu 7. Hòa tan 30 gam hỗn hợp oxit kim loại thì cần x mol HCl . Cô cạn dung dịch sau thu được 44.2 gam muối clorua. X có giá trị nhỏ nhất là : A. 0.13 mol B. 0.39 mol C. 0.26 mol D. 0.52 mol Câu 8. Cho phản ứng 2H2 + O 2 2H2O + H = +80kj Phát biểu đúng : A. Cứ 2 mol H2 tác dụng với 1 mol O2 giải phóng 80 kj. B. Để thu được 2 mol H2O từ 2 mol H2 và 1 mol O2 thì cần cung cấp năng lượng 80 kj. C. Để có 1 mol H2O từ qmol H2 và 0.5 mol O2 thì cần năng lượng cung cấp là 80 kj D. để tạo ra 2 mol H2O từ 2 mol H2 và 1 mol O2 thì giải phóng năng lượng 80 kj. Câu 9. Cho FeO tác dụng với HNO3 thu được khí NO. Phương trình có tổng hệ số cân bằng là : A. 20 B. 24 C. 22 D. 26 Câu 10. A, B, C là ba nguyên tố có tổng số proton là 36. Xác định tổng số electron độc thân của X, Y, Z. A. 2 B. 3 C. 1 D. 5 Câu 11. Chọn phát biểu đúng về phản ứng oxi hóa khử. A. Phản ứng hóa học trong đó có sự thay đổi proton. B. Phản ứng chỉ có dự mất electron. C. Phản ứng hóa học chỉ có sự nhận electron. D. Phản ứng hóa học có sự thay đổi số oxi hóa trước và sau phản ứng. Câu 12. Cho quá trình khử sau : N2 + ae → nN3-. a có giá trị : A. 3 B. 2 C. 6 D. 12 Câu 13. Cho phản ứng hóa học sau : HCl + K2Cr2O7 → KCl + CrCl3 + Cl2 + H2O. Số phân tử HCl đóng vai trò môi trường. A. 14 B. 8 C. 12 D. 6 Câu 14. Cho phản ứng hóa học sau đây : S + O2 → SO2. Phát biểu sai là : A. S là chất khử. B. S là chất bị oxi hóa. C. S là chất mất electron. D. S là chất bị khử. Câu 15. Cho 2,7 gam Al tác dụng với dung dịch HNO 3 dư thu được 6.72 lít khí X. ( duy nhất) . Khối lượng dung dịch sau phản ứng : A. Tăng 11,1 găm B. Tăng 2,7 gam. C. Giảm 11.1 gam D. Giảm 13.8 gam. Câu 16. Tinh thể nào sau đây là tinh thể nguyên tử : A. Kim cương. B. Nước đá. C. Muối ăn D. Iot. Câu 17. Cho phản ứng hóa học sau đây : ½ N2 + 3/2 H 2 H của phản ứng 2NH 3 NH3 + 180 kj. N2 + 3H2 có giá trị là : A. +90 kj B. - 90 kj C. +360 kj D. -360 kj Câu 18. Cho phản ứng hóa học Al + HNO3 → Al(NO3)3 + N2 + H2O. Số phân tử HNO3 đóng vai trò môi trường là : A. 36 B. 30 C. 6 D. 32 Câu 19. Phản ứng nào sau đây luôn là phản ứng oxi hóa khử : A. Tao đổi. B. Phân hủy. C. Kết hợp D. Thế. Câu 20. Dãy các chất nào sau đây chỉ có liên kết ion. A. H2O, NaCl, CaO, KCl B. CaO, MgO, KCl, Na2O. C. CH4, NH3, SO2, CO2 D. KCl, NH2, CaO, H2O. II. Phần tự luận : Câu 1. X+, Y- có cấu hình electron giống cấu hình của Ar. a. Xác định vị trí của X, Y trong bảng tuần hoàn. b. Viết công thức oxit cao nhất, hợp chất khí với hidro, và công thức hidroxit cao nhất. c. Cho 2.34 gam X tác dụng với 0.56 lít khí Y2 ( đktc). Tính khối lượng chất rắn tạo thành. Câu 2.Cho 8,5 gam hỗn hợp gồm hai kim loại kiềm thuộc hai chu kỳ liên tiếp nhau tác dụng với dung dịch HCl 36.5%, d = 1,25g/ml vừa đủ thì thu được 3.36 lít khí ( đktc). a. Xác định tên hai kim loại và % theo khối lượng của hai kim loại. b. Tính C% của dung dịch tạo thành. c. Nếu cho 22.5 gam hỗn hợp hai kim loại trên tác dụng với V lít dung dịch ở trên ( biết dư 20% so với lượng cần phản ứng) Tính V ? ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 6) I. Phần trắc nghiệm : Câu 1. Sắp xếp số oxi hóa của N theo chiếu tăng dần. N2, NO, N2O, NH3, NaNO3, NO2, N2O, N2O3. A. NH3, N2, N2O, NO, N2O3, NO2, NaNO3. B. N2O, NO, N2O3, NH3, N2, NO2, NaNO3. C. N2, NO2, NaNO3.N2O, NO, N2O3, NH3, D. NaNO3.N2O, NO, N2O3, N2, NO2, NH3, Câu 2. Một nguyên tố M thuộc nhóm VII. Có tổng số hạt là 80. Số p và n của M là: A. 25, 30 B. 35, 45 C. 17 , 46 D. Số khác. Câu 3. Cho 7.2 gam kim loại hóa trị 2 tác dụng với dung dịch HNO 3 thu được 4.48 lít khí NO ( đktc) . Kim loại đó là: A. Mg B. Zn C. Ca D. Cu Câu 4. X thuộc nhóm IVA % X trong hợp chất khí với hidro là 75%. % X trong oxit cao nhất là: A. 33.7% B. 43.7% C. 34.8% D. 27.38% Câu 5. Cho Fe + O2 → Fe3O4. Nếu khối lượng của Fe là 22.4 gam thì số mol electron Fe đã nhường là: A. 1.2 B. 0.3 C. 0.8 D. 1.06 2+ 6 Câu 6. X có cấu hình electron ở phân lớp ngoài cùng là 3d . Vị trí của X trong bảng tuần hoàn là: A. Chu kì 4, nhóm VIA. B. Chu kì 4, nhóm VIIIB. C. Chu kì 4, nhóm IIA D. Chu kì 3, nhóm VIA. Câu 7. Hỗn hợp gồm Cu và Fe có khối lượng 12 gam trong đó số mol Cu bằng số mol Fe tác dụng hết với dung dịch HNO3 thu được V lít khí NO2 ( đktc). Giá trị của V là: A. 8.96 lít B. 11.2 lít C. 1.12 lít D. 22.4 lít Câu 8. X, Y có tổng số electron là 28, cách nhau 3 nguyên tố. ( Z Y > ZX). Cho 4.8 gam X tác dụng với 3.2 gam Y. Tính khối lượng sản phẩm tạo thành. A. 5.6 gam. B. 8 gam C. 2.8 gam C. 6.4 gam Câu 9. Chp phân tử H2SO3. Số liên kết cho nhận là: A. 1 B. 2 C. 3 D. 4 Câu 10. Sắp xếp độ phân cực tăng dần của các chất cho sau đây: Cl 2O7, P2O5, SO3, CO2. A. P2O5, CO2, SO3, Cl2O7. B. CO2, P2O5, SO3, Cl2O7. C. SO3, Cl2O7.CO2, P2O5, D. Cl2O7.CO2, P2O5, SO3, Câu 11. Cho 30 gam hỗn hợp các kim loại Al, Mg, Fe tác dụng với oxi vừa đủ được 34.8 gam hỗn hợp chất X. Hòa tan hỗn hợp X cần phải dùng V lít dung dịch HCl 0.5M. Tính V? A. 2.4 lít B. 1.2 lít C. 0.6 lít D. 4.8 lít Câu 12. Cho ion X3+ có cấu hình electron ở lớp vỏ: 3d3. X có số electron độc thân là: A. 3 B.4 C. 5 D. 6 Câu 13. Phản ứng nào sau đây luôn là oxi hóa khử. (1). Thế. (2). Kết hợp (3). Cháy (4). Trao đổi. A. (1). B. (1), (3). C. (2) (3). D. (2), (4). Câu 14. Cho phản ứng sau: N2 + 3H 2 2NH3 H = -92 kj Hỏi khi phân hủy 6.72 lít khí NH3 ( đktc) thành N2 và H2 thì có H là? A. 13.8 kj B. -13.8kj C, 46kj D. -46kj + Câu 15. Ion AO2 có tổng số electron là 30. Y có tổng số electron bằng 10. Hợp chất tạo ra bởi hai ion trên là: A. NaNO2 B. KAlO2 C. NaAlO2 D. KNO2 Câu 16. Phân tử nào sau đây vừa có liên kết cộng hóa trị có cực, liên kết cho nhận và liên kết ion : A. K2CO3 B. KCl C. K2SO4 D. KF. Câu 17. Cho phản ứng hóa học sau: Al + HNO 3 → Al(NO3)3 + NH4NO3 + H2O. Tổng hệ số cân bằng của các chất tham gia phản ứng là: A. 33 B. 38 C. 30 D. 58 Câu 18. Sắp xếp theo chiếu độ phần cực tăng dần nào sau đây là đúng: A. H2O, H2Te, H2Se, H2S. B. H2O, H2S, H2Se, H2Te. C. H2Te, H2Se, H2S, H2O. D. H2Se, H2S.H2O, H2Te, Câu 19. X nằm chu 3, nhóm VIA. %X trong oxit cao nhất là: A. 60% B. 40% C. 25% D. 45% Câu 20. Mg + H2SO4 → MgSO4 + S + H2O. Tìm số phân tử H2SO4 bị khử và môi trường. A. 3, 8 B. 2,7 C. 1,3 D. 2,5 II. Phần tự luận: Câu 1. Cho X+ và Y2- đều có cấu hình electron ở phân lớp ngoài cùng là 3p 6. a. Xác định vị trí của X, Y trong bảng tuần hoàn. b. Viết công thức oxit cao nhất và hợp chất với hidro, công thức hidroxit cao nhất của X, Y. c. Viết công thức cấu tạo của oxit và hidroxit của X và Y. Câu 2. Cho 16.8 gam hỗn hợp gồm hai kim loại thuộc nhóm IIA ( nằm ở hai chu kỳ liên tiếp nhau) tác dụng với HCl 0.5M vừa đủ thu được 11.2 lít khí ( đktc). a. Xác định tên hai kim loại. b. Tính % khối lượng hai kim loại. c. Nếu cho hỗn hợp hai kim loại trên tác dụng với dung dịch HCl ( ở trên) biết dư 25% so với lượng cần phản ứng. Tính thể tích dung dịch HCl đã dùng. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 7) I. Phần trắc nghiệm: Câu 1. Cho PTHH của phản ứng sau: aAl + bH2SO4 cAl2(SO4)3 + dH2S + eH2O Tổng hệ số cân bằng ( b + c ) là: A. 12 B. 19 C. 18 D. 15 Câu 2 Cho 9,6 g kim loại M tác dụng với dung dịch HNO3 loãng, dư thu được 2,24 lít khí duy nhất NO (đktc). M là: A. Mg B. Fe C. Zn D. Cu Câu 3 Hỗn hợp X gồm Cu và Fe. Trong đó Cu chiếm 43,24% khối lượng. Cho14,8 g X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc) bay ra. Giá trị của V là: A. 3,36 lít B. 2,24 lít C. 4,48 lít D. 1,12 lít Câu 4: Cho dãy các chất: FeO, Al2O3, Fe3O4, Fe(OH)2 , HCl, Fe2O3. Số chất trong dãy bị oxi hoá bởi dung dịch H 2SO4 đặc, nóng là A. 6. B. 5. C. 4. D. 3. Câu 5: Hoà tan 8,2 gam hỗn hợp X gồm Fe và Al bằng dd HCl tạo ra 7,84 lhí khí H 2(đktc). Thành phần % khối lượng của Fe và Al trong X lần lượt là A. 50% và 50% B. 65,85% và 34,15% C. 34,15% và 65,85% D. 20% và 80% Câu 6. Cho 5,4 gam Al tác dụng với HNO3 thoát ra khí NO2 . Tính số mol HNO3 đóng vai trò môi trường: A. 0,6 B. 0,2 C. 0,8 D. 0,5 Câu 7. Cho Al → Al3+ + 3e. Đi từ 13,5 gam Al . sẽ có bao nhiêu mol e được tách ra. A. 0.5 B. 0.25 C. 1.5 D. 1.7 Câu 8. Trong phân tử CO2 có bao nhiêu liên kết pi. A. 4 B. 2 C. 1 D. 3 Câu 9.Sắp xếp số e trong các ion sau theo thử tự tăng dần. NH4+, SO32-, CO32-. A. NH4+ < SO32- < CO32B. NH4+ < CO32- < SO3222+ C. SO3 < CO3 < NH4 D. CO32-< NH4+ < SO32Câu 10. X , Y nằm cùng một chu kì, 2 nhóm liên tiếp có tổng e bằng 25. Tính số mol của e nhương đi từ 0,1 mol X và 0.2 mol Y. A. 0.6 B.0,8 C. 0.7 D. 0.5 Câu 11. Cho 32 gam hỗn hợp Al, Fe, Zn tác dụng vừa đủ với V lít dung dịch HCl 0,5M thu được 44,2 gam muối. Giá trị V : A. 0.2 lít B. 0.4 lít C. 0.8 lít D. số khác. Câu 12. Nguyên tố X nằm chu kì 3, nhóm VIA. X thuộc nguyên tố nào sau đây: A. s B, p C. f D. d Câu 13. X có hai đồng vị có số khối 13 và 11. Có % đồng vị bằng nhau. 0,25 mol X có khôi lượng: A. 3 B. 12 C/ 4 D. 6 Cho phản ứng hoá học: Fe + CuSO FeSO + Cu. Câu 14: Trong phản ứng này đã xảy ra: 4 4 2+ A. Sự oxi hoá Fe và sự oxi hoá Cu. B. Sự khử Fe và sự oxi hoá Cu. 2+ 2+ 2+ C. Sự khử Fe và sự khử Cu D. Sự oxi hoá Fe và sự khử Cu Câu 15. Số liên kết pi và liên kết xichma trong phân tử H2CO3: A. 5,1 B. 1.5 C. 2.4 D. 4.2 Câu 16. Cho 2,6 g bột kẽm vào 100 ml dung dịch CuCl 2 0,75 M . Lắc lĩ cho đến khi phản ứng kết thúc Khối lượng Cu kết tủa là bao nhiêu gam A. 6.4 B. 2.56 C. 2.65 D. 4.6 Câu 17. câu sai trong các câu sau đây: A. Nước đá thuộc loại tinh thể phân tử. B. Trong tinh thể phân tử, lực liên kết giữa các phân tử là liên kết cộng hóa trị. C. Trong tinh thể phân tử, lực liên kết giữa các phân tử là liên kết yếu. D. Tinh thể iot là tinh thể phân tử. Câu 18: Hiđroxit cao nhất của một nguyên tố R có dạng HRO 4. R cho hợp chất khí với hiđro chứa 2,74% hiđro theo khối lượng. R là nguyên tố A. Br. B. Cl. C. I. D. F. Câu 19: Cho 6,9g một kim loại X thuộc nhóm IA tác dụng với nước. Toàn bộ khí thu được cho tác dụng với CuO đun nóng. Sau phản ứng thu được 9,6g đồng kim loại. Kim loại X là A. Na. B. Li. C. K. D. Rb. Câu 20: Cho phản ứng hóa học: N2 + O 2 2NO có H = +180kj H của phản ứng : NO → 1/2N2 + 1/2O2 có giá trị : A. +90kj B. +-90kj C. +360kj D. -360kj Câu 21. Cho một kim loại X có khối lượng 1.44 gam tác dụng vừa đủ với 500 ml dung dịch H 2SO4 0.08M và HCl 0.08M. cô cạn dung dịch sau phản ứng thu được m gam muối. Tìm kim loại X và m ? X là : m= Câu 22. Hỗn hợp gồm 3 kim loại : Al, Fe, Cu có khối lượng m gam. Tác dụng với O 2 ( dư) thu được 73 gam hỗn hợp các oxit gồm Al2O3, Fe3O4, FeO, Fe2O3, CuO. Để hòa tan hỗn hợp này cần dùng vửa đủ 146 gam dung dịch HCl 50%. Tính m ? m = ............ Câu 23. Cho một kim loại X hóa trị n có khối lượng 1.215 gam. Tác dụng với dung dịch H 2SO4 đặc, nóng (dư) thu được 378 ml khí H2S ( đktc). Tìm kim loại X. Kim loại X là : ........ Câu 24. Cho một oxit Fe có khối lượng 139,2 gam tác dụng với dung dịch HNO 3 ( dư) thì thu được muối Fe(NO3)3 và hỗn hợp hai khí NO2 và NO có thể tích 8.96 lít và có tỉ lệ mol NO 2: NO = 3:1. Tìm công thức của oxit Fe. Công thức của oxit Fe là : ........... II. Phần tự luận: Câu 1. A2+ có cấu hình electron của Ne, B2- có cấu hình electron của Ar. a. Xác định vị trí của A và B trong bảng tuần hoàn. b. Viết công thức oxit cao nhất của , hợp chất với H, công thức hidroxit cao nhất của A và B. c. Cho hỗn hợp gồm A, B có khối lượng 2.64 gam( tỉ lệ mol A : B là 1:2). Cho hỗn hợp tác dụng với H2SO4 đặc dư, tính thể tích khí SO2 tạo thành. Câu 2. Cho 10.1 gam hỗn hợp gồm hai kim loại kiềm( liên tiếp nhau) tác dụng với 90.2 gam nước thoát ra 3.36 lít khí H2 ( đktc). a. Xác định tên hai kim loại. b. Tính C% của dung dịch tạo thành. c. Cần dùng bao nhiêu lít dung dịch H2SO4 1M đê trùn hóa hết dung dịch tạo thành. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 8) I. TRẮC NGHIỆM: Câu 1: Ion R+ có cấu hình electron phân lớp ngoài cùng là 3p6. R thuộc chu kì nào? Nhóm nào? A. Chu kì 4, nhóm IIA B. Chu kì 4, nhóm IA C. Chu kì 3, nhóm VIA D. Chu kì 3, nhóm VIIIA Câu 2: Nguyên tố R thuộc chu kì VIA nên cấu hình e nguyên tử của R ở trạng thái cơ bản là A. np6 B. ns2np4 C. nd6 D. (n – 1)d5 s1 Câu 3: Cho phương trình hoá học : 3NO2 + H2O → 2HNO3 + NO. Trong phản ứng trên, NO2 có vai trò gì? A. Không là chất khử cũng không là chất oxi hoá. B. Là chất oxi hoá. C. Là chất khử. D. Vừa là chất khử, vừa là chất oxi hoá. Câu 4: Cho các nhận định sau, số nhận định đúng. (1). Cu thuộc chu kỳ 4, nhóm IB. (2). Oxit cao nhất của nguyên tố có dạng ROx thì công thức hợp chất khí với H là RH(8-x). (3). Trong chu kì, hóa trị của nguyên tố trong hợp chất khí với hidro tăng dần từ 1 đến 4. (4). Nếu không xét nguyên tố phóng xạ thì kim loại manh nhất là Cs. A. 1 B. 2 C. 3 D. 4 Câu 5: Cho 31.2 gam Kali tác dụng với 182.5 gam dung dịch HCl 10% . Nồng độ C% của dung dịch sau phản ứng có giá trị nào sau đây: A. 17.5% B. 7.89% C. 25.39% D. 17.5% và 7.89% 23 Câu 6: Nguyên tử 11 Na có số proton, electron và nơtron lần lượt là A. 11, 11, 12. B. 11, 12, 11. C. 11, 12, 13. D. 11, 11, 13. Câu 7: Cho 9.9 hỗn hợp gồm hai muối cacbonat A2CO3 và BCO3 tác dụng với dung dịch HCl dư thu được 10.78 gam muối clorua khan và V lít khí ( đktc). Giá trị của V là: A. 1.344 lít B. 1.792 lít C. 1.586 lít D. 2.24 lít Câu 8: Cho phản ứng: Zn + CuCl2 ZnCl2+ Cu. Trong phản ứng này, 1 mol Cu2+ A. đã nhận 1 mol electron. B. đã nhận 2 mol electron. C. đã nhường 1 mol electron. D. đã nhường 2 mol electron. Câu 9: Cho 28 gam kim loại kiềm thổ M tác dụng với 500 ml H 2O thu được dung dịch X và khối lượng của dung dịch tăng thêm 26.6 gam. Nồng độ C% của dung dịch sau là: A. 12.4% B. 10.5% C. 9.81% D. 9,84% Câu 10: Cho 6,5 g kim loại M hoá trị II tác dụng hết với 36,5 g dung dịch HCl, thu được 42,8 g dung dịch X và khí hiđro. M là A. Zn ( M= 65) B. Cu ( M= 64) C. Ca ( M= 40) D. Fe ( M= 56) Câu 11: Nguyên tố X có thứ tự là 20, vị trí của nguyên tố X trong bảng HTTH là: A. Chu kì 4, nhóm VIIIA. B. Chu kì 3, nhóm IIA. C. Chu kì 4, nhóm IIA. D. Chu kì 4, nhóm IIIA. Câu 12: Các nguyên tố Mg, Al, B và C được sắp xếp theo thứ tự tăng dần độ âm điện : A. Mg < B < Al < C ; B. Mg < Al < B < C; C. B < Mg < Al < C ; D. Al < B < Mg < C. Câu 13: Tổng số hạt cơ bản (p, n, e) trong ntử nguyên tố X là 46, biết số hạt mang điện nhiều hơn số hạt không mang điện là 14. Xác định chu kì, số hiệu nguyên tử của X trong BTH? A. Chu kì 2, ô 7 B. Chu kì 3, ô 15 C. Chu kì 3 ô 16 D. Chu kì 3 ô 17 Câu 14: Cặp chất chứa liên kết cộng hóa trị phân cực là A. Cl2 và HCl B. H2O và HCl C. N2 và Cl2 D. H2O và NaCl Câu 15 : Cho cấu hình electron của các nguyên tố sau: a. 1s2 2s2 2p6 3s2 2 2 6 2 6 1 2 2 6 2 6 b. 1s 2s 2p 3s 3p 4s c. 1s 2s 2p 3s 3p d. 1s2 2s2 2p6 3s2 3p6 3d6 4s2 Các nguyên tố kim loại là trường hợp nào sau đây? A. a, b, c. B. a, b, d. C. b, c, d. D. a, c, d. Câu 16: Chỉ ra nội dung sai : Tính phi kim của nguyên tố càng mạnh thì A. khả năng thu electron càng mạnh. B. độ âm điện càng lớn. C. bán kính nguyên tử càng lớn. D. tính kim loại càng yếu. Câu 17: Hòa tan hoàn toàn 3,1g hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp vào nước thu được 1,12 lít hiđro (đktc). Hai kim loại kiềm đã cho là A. Li và Na B. Na và K C. K và Rb D. Rb và Cs Câu 18: Cho nguyên tố có Z = 17, nó có hoá trị cao nhất với oxi là : A. 3. B. 5 C. 7 D. 8 Câu 19: Oxit cao nhất của nguyên tố R ứng với công thức RO 2 . Trong hợp chất của R với hidro có 75%R và 25% H. Nguyên tố R đó là : A. Magie. B. Cacbon. C. Nitơ. D. Photpho. Câu 20: Dãy những hợp chất chứa liên kết ion A. NaCl, CaF2, H2, HCl. B. KCl, CaO, CaF 2, NaBr. C. NaCl, CaF2, NaBr, HCl D. NaCl, CaF 2, CO2, NaBr. Câu 21: Trong các phản ứng sau, phản ứng HCl đóng vai trò là chất oxi hóa là A. HCl + NaOH NaCl + H2O B. 16HCl + 2KMnO4 2MnCl2 + 5Cl2 + 8H2O + 2KCl C. 2HCl + Fe FeCl2 + H2 D. 4HCl + MnO2 MnCl2 + Cl2 + 2H2O Câu 22: Cho các phản ứng sau, ở phản ứng nào NH3 không đóng vai trò chất khử ? xt A. 4NH3 + 5O2 → 4NO + 6H2O B. 2NH3 + 3Cl2 t → N2 + 6HCl C. 2NH3 + 3CuO → 3Cu + N2 + 3H2O D. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4 Câu 23: Cho phản ứng: a Fe + b HNO 3 c Fe(NO3)3 + d NO + e H2O. Các hệ số a, b, c, d, e là những số nguyên, đơn giản nhất. Tổng a + b bằng A. 5 B. 4 C. 7 D. 6 Câu 24. Hai kim loại X và Y đứng kế tiếp nhau trong một chu kỳ có tổng số proton trong hai hạt nhân nguyên tử là 25. Số electron lớp ngoài cùng của X và Y lần lượt là : A. 1 và 2 B. 2 và 3 C. 1 và 3 D. 3 và 4 II. TỰ LUẬN: Câu 1: Cân bằng các phản ứng oxi hóa – khử sau đây theo ppháp thăng bằng electron, xác định chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử o 0 1. Al + H2SO4 (đặc) t Al (SO ) 2 4 3 + SO2 + H2O 2. H2S + O2 SO2 + H2O Câu 2: Cho hỗn hợp X gồm 2 muối cacbonat của 2 kim loại A, B thuộc nhóm IA, có chu kì liên tiếp nhau trong bảng tuần hoàn hóa học. Cho 38,2 gam X tác dụng với dung dịch HCl vừa đủ thì thu được 6,72 lít CO2 (đktc). a. Xác định 2 kim loại. b. Tính khối lượng từng chất trong hỗn hợp ban đầu. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 9) I.TRẮC NGHIỆM : 26 55 26 Câu 1. Nhận định nào sau đây đúng khi nói về 3 nguyên tử: 13 X ; 26 Y ; 12 Z A. X, Z là 2 đồng vị của cùng một nguyên tố hoá học B. X, Y thuộc cùng một nguyên tố hoá học C. X và Y có cùng số nơtron. D. X và Z có cùng số khối. Câu 2. Liên kết giữa Si và H là : ( biết Si = 1,9 ; H = 2,2) A. liên kết cộng hóa trị không phân cực B. liên kết ion . C. liên kết cộng hóa trị có phân cực D. liên kết đơn. Câu 3. Cho 5,4 gam một kim loại M tác dụng hết với khí Cl 2 thu được 26,7gam muối. M là kim loại nào trong các kim loại sau : A. Fe B. Zn C. Al D. Mg Câu 4. Chọn câu sai: Trong phản ứng : 2FeCl2 + Cl2 2 FeCl3 A. ion Fe2+ bị oxi hóa. B. ion Fe2+ oxi hóa nguyên tử Cl. C. ion Fe2+ khử nguyên tử Cl. D. nguyên tử Cl oxi hóa ion Fe2+. Câu 5. Hợp chất khí với Hiđrô của nguyên tố X là XH3, Cthức ôxit cao nhất của X là : A. X2O5 B. X2O3 C. X2O D. XO3. Câu 6. Kim loại X là kim loại kiềm. Hòa tan m gam kim loại X vào 30 gam nước thì thoát ra 2,8 lít khí ( đktc) và dung dịch sau phản ứng có C% = 35,44%. X là A. K ( M= 39). B. Na ( M= 23) C. Li (M=7) D.Rb ( M=85) Câu 7. Trong phản ứng : Cl2 + 2KOH KCl + KClO + H2O A. Cl2 Vừa là chất oxi hoá, vừa là chất khử. C. Cl2 Chỉ là chất oxi hoá . B. Cl2 Không là chất oxi hoá, không là chất khử. D. Cl2 Chỉ là chất khử Câu 8. Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđrô là RH 3. Cấu hình e nào sau đây của R là đúng nhất: A.1s22s22p1. B. 1s22s22p5 C. 1s22s22p3 D. 1s22s2. Câu 9. Tổng hạt mang điện tích âm trong ion NO3- là: A. 32 B. 33 C. 31 D. 30 Câu 10. Tính phi kim của các halogen giảm dần theo thứ tự: A. F, I, Cl, Br B. F, Br, Cl, I C. I, Br, Cl, F D. F, Cl, Br, I Câu 11. Số oxi hóa của S trong các chất Na2S, S, Na2SO4 và K2SO3 lần lượt là: A. -2, 0, +6, +4. B. -2, +4, 0, +6. C. -2, 0, +4, +6 D. +4, -2, 0, +6 Câu 12. Hai nguyên tử khác nhau, muốn có cùng kí hiệu nguyên tố thì phải có tính chất nào sau đây: A. Cùng số khối. B. Cùng số prôtôn. C. Cùng số nơtron và số khối . D. Cùng số nơtron. Câu 13. Dãy những hợp chất chứa liên kết ion A. NaCl, CaF2, NaBr, HCl B. NaCl, CaF2, CO2, NaBr. C. NaCl, CaF2, H2, HCl. D. KCl, CaO, CaF2, NaBr. Câu 14. Cho cấu hình electron của A là : 1s 22s22p63s23p63dx4s2 . Giá trị x để A ở chu kì 4, nhóm IIA trong bảng TH là : A. 0 B. 10 C. 7 D. 8 Câu 15. Trong các PƯHH sau đây: Phản ứng nào không có sự nhường và nhận e: A. KMnO4 + H2SO4 K2SO4 + MnSO4 + O2 + H2O. B. NaCl + H2O dp NaOH + Cl2 + H2O. C. Al + Fe2O3 Fe + Al2O3 . D. Fe3O4 + H2SO4 FeSO4 + Fe2(SO4)3 + H2O. Câu 16. Phân tử nào sau đây có liên kết cộng hóa trị phân cực mạnh nhất ? A. CH4 B. N2 C. H2 D. HCl Câu 17. Một nguyên tử X có tổng số hạt p,n,e bằng 40.Trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Số khối của nguyên tử X là: A. 13 B. 40 C. 14 D. 27 Câu 18. Khi cho 0,6 g một kim loại nhóm IIA tác dụng với nước tạo thành 0,336 lít khí hiđro (ở đktc ). Kim loại đó là kim loại nào sau đây : A. Mg B. Ca C.Ba D.Sr Câu 19. A có hoá trị III với H. Trong hợp chất oxit cao nhất chứa 56,34% oxi theo khối lượng. Tìm A A. N B. C C. S D. P Câu 20. Hòa tan hoàn toàn m gam Al vào dung dịch HNO 3 loãng, dư thu được 672 ml khí N2. Giá trị m bằng: A.0,27 gam B.0,81 gam C.0,54 gam D.2,70 gam. Câu 21: Một nguyên tố kim loại trong cấu hình electron nguyên tử chỉ có 5 electron s . Cho m gam kim loại này hoà tan hoàn trong nước thu được 22,4 lít khí H2 ( ở đktc). Giá trị của m là: A. 23 B. 39 C. 46 D. 78 Câu 22: Đốt 1 lượng nhôm(Al) trong 6,72 lít O2. Chất rắn thu được sau phản ứng cho hoà tan hoàn toàn vào dung dịch HCl thấy bay ra 6,72 lít H 2 (các thể tích khí đo ở đkc). Khối lượng nhôm đã dùng là A. 8,1gam. B. 16,2gam. C. 18,4gam. D. 24,3gam. Câu 23: Các nguyên tố: Cl, C, Mg, Al, S được sắp xếp theo thứ tự tăng dần hoá trị cao nhất với oxi. Đó là: A. Cl, C, Mg, Al, S B. S, Cl, C, Mg, Al C. Mg, Al, C, S, Cl D. Cl, Mg, Al, C, S Câu 24: Cho 4,04g hh Al, Fe, Cu tác dụng với oxi dư thu được 5,96g hỗn hợp oxit. Thể tích dd HCl 2M cần để hòa tan hết hỗn hợp oxit là A. 0,06 lít B. 0,12 lít C. 0,24 lít D. 0,48 lít II.TỰ LUẬN : Câu 1 : Cân bằng các phương trình sau theo phương pháp thăng bằng electron, xác định chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử : 0 a. Cl2 + KOH t KClO3 + KCl + H2O b. HNO3 + H2S NO + S + H2O Câu 2: Khi cho 4,6 gam một kim loại kiềm tác dụng với nước thì có 2,24 lít khí H2 thoát ra ở đktc a. Hãy cho biết tên kim loại kiềm đó? b. Tính V H2SO4 0,5 M cần để trung hòa hết dd sau phản ứng ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 10) I.Trắc nghiệm: Câu 1: Cho a Fe + b HNO3 c Fe(NO3)3 + d NO + e H2O. Các hệ số a, b, c, d, e là những số nguyên, đơn giản nhất. Tổng hệ số cân bằng của các chất có trong phản ứng bằng: A. 5 B. 4 C. 9 D. 8 Câu 2: Hai kim loại X và Y đứng kế tiếp nhau trong một chu kỳ có tổng số proton trong hai hạt nhân nguyên tử là 25. Số thứ tự nhóm của X và Y lần lượt là : A. IA và IIA. B. IIA và IIIA C. IIIA và IVA. D. IVA và VA Câu 3: Cho nguyên tố A có Z = 15, A có hoá trị cao nhất với oxi là : A. 4. B. 5 C. 6 D. 7 Câu 4: Hòa tan hoàn toàn 4,5 g hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp vào dung dịch HCl dư thu được 1,68 lít hiđro (đktc). Hai kim loại kiềm đã cho là A. Li(7) và Na(23) B. Na(23) và K(39) C. K(39) và Rb(85) D. Rb(85) và Cs(133) Câu 5 : Hòa tan hoàn toàn m gam Fe (56) vào dung dịch HNO3 loãng, dư thu được 672 ml khí N2. Giá trị m bằng: A.11,2 gam B.8,4 gam C.0,56 gam D.5,6 gam. Câu 6: Một nguyên tử X có tổng số hạt p,n,e bằng 34.Trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Số khối của nguyên tử X là: A. 11 B. 23 C. 12 D. 34 Câu 7: Cho công thức oxit cao nhất của X là X2O5 , trong công thức hợp chất khí với H, X chiếm 82,353% về khối lượng. X là: A. Nito (N=14). B. Photpho(P = 31) C. Asen (As=75). D. Cacbon (C=12). Câu 8: Dãy chất nào sau đây có số oxi hóa của N theo thứ tự giảm dần ? A. HNO3 , NO, NO2, N2O3, NH3. B. HNO3 , NO2, N2O3, NH3,NO. C. NO, HNO3 , NO2, N2O3, NH3. D. HNO3 , NO2, N2O3, NO, NH3. Câu 9: KMnO4 + FeSO4 + H2SO4 Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là A. 5 và 2. B. 2 và 10. C. 2 và 5. D. 5 và 1. Câu 10 : Phân tử nào sau đây có liên kết cộng hóa trị phân cực mạnh nhất ? A. HI B. NH3. C. HCl. D. HF Câu 11 : Cho các phản ứng sau đây (chưa xét đến hệ số cân bằng của phản ứng) ; số phản ứng thuộc loại phản ứng oxi hóa khử là : (a) Cu + H2SO4 CuSO4 + SO2 + H2O. (b) Fe3O4 + HCl FeCl2 + FeCl3 + H2O. (c) FeO + HNO3 Fe(NO3)3 + NH4NO3 + H2O. (d) CaCO3 + HCl CaCl2 + CO2 + H2O. (e) Al + NaOH + H2O NaAlO2 + H2. A. 2. B. 3. C. 4. D. 5 Câu 12: Hạt nhân nguyên tử X chứa số hạt mang điện là 19, hạt không mang điện nhiều hơn hạt mang điện là 1. Vậy tổng số hạt cơ bản trong nguyên tử X là A. 20. B. 39. C. 58. D. 19. Câu 13: Nguyên tử các nguyên tố X, Y, Z có cấu hình electron: X: 1s22s22p63s23p1 ; Y: 1s22s22p63s23p6 ; Z: 1s22s22p63s23p64s2 . Trong các nguyên tố X, Y, Z nguyên tố kim loại là A. X và Z B. X và Y. C. Y và Z D. X 26 26 27 Câu 14 : Nhận định nào sau đây không đúng khi nói về 3 nguyên tử: 13 X ; 12 Y ; 13 Z A. X, Z là 2 đồng vị của cùng một nguyên tố hoá học B. X, Y có cùng số notron. C. Y và Z có cùng số nơtron. D. X và Y có cùng số khối. Câu 15 : Phản ứng nhiệt phân muối thuộc phản ứng A. oxi hóa – khử. B. không oxi hóa – khử. C. oxi hóa – khử hoặc không. D. thuận nghịch. Câu 16: Các nguyên tố Mg, Al, B và C được sắp xếp theo thứ tự tăng dần độ âm điện : A. Mg < B < Al < C . B. Mg < Al < B < C. C. B < Mg < Al < C . D. Al < B < Mg < C. Câu 17: Tổng hạt electron trong ion CO32- là: A. 32 B. 33 C. 31 D. 30 Câu 18 : Chỉ ra nội dung sai : Tính phi kim của nguyên tố càng mạnh thì A. khả năng thu electron càng mạnh. B. độ âm điện càng lớn. C. bán kính nguyên tử càng lớn. D. tính kim loại càng yếu. Câu 19: Hai nguyên tử của cùng một nguyên tố thì phải có cùng tính chất nào sau đây: A. Cùng số khối. B. Cùng số prôtôn. C. Cùng số nơtron và số khối . D. Cùng số nơtron. Câu 20 : Số oxi hóa của oxi trong các hợp chất HNO3, H2O2, F2O, KO2 theo thứ tự là A. -2, -1, -2, -0,5. B. -2, -1, +2, -0,5. C. -2, +1, +2, +0,5. D. -2, +1, -2, +0,5. Câu 21 : Kim loại M hóa trị II phản ứng vừa đủ với dung dịch H2SO4 10% thu được 2,24 lít khí (ở đkc) và dung dịch X chỉ chứa 1 chất tan duy nhất có nồng độ % là 11,976 %. Xác định kim loại M. A. Mg B. Ca C. Zn D. Ba Câu 22. Cho hỗn hợp gồm Li, Na, Ca, Ba có khối lượng m gam hòa tan vào nước ( dư) được dung dịch X và 2.24 lít H2( đktc). Cô cạn dung dịch X thu dược 9.97 gam chất rắn. Giá trị của m là: A. 6.57 gam B. 8.27 gam C. 9.77 gam D. 6.15 gam Câu 23 : Cho các nhận xét sau đây. Có bao nhiêu nhận xét đúng? I. Hợp chất khí với Hiđrô của nguyên tố X là XH3 thì công thức ôxit cao nhất của X có thể là X2O5. II. Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđrô là RH2 thì cấu hình e của R có thể là 1s22s22p4. III. Cho cấu hình electron của A là : 1s22s22p63s23p63d14s2. Vậy A thuộc chu kì 4, nhóm IIA. IV. Liên kết hóa học trong phân tử NaCl là liên kết cộng hóa trị. A.1. B. 3. C. 2. D. 4. 2+ 2 6 Câu 24. R có cấu hình electron là 2s 2p . Hiệu số electron s của R và X là 1. Số nguyên tố X thõa mãn điều kiện trên A. 1 B. 2 C. 3 D. 4 II.Tự luận: Bài 1: Nguyên tố R thuộc nhóm VIIA. Tỉ lệ khối lượng mol giữa hợp chất khí với hiđro và oxit cao nhất của R là 73 : 366. Xác định nguyên tử khối của R. Bài 2: Cân bằng các phương trình oxi hóa khử sau bằng phương pháp thăng bằng electron. Xác định chất khử , chất oxi hoá, quá trình khử, quá trình oxi hoá. a. Cu + H2SO4 CuSO4 + SO2 + H2O. b. Al + HNO3 Al(NO3)3 + N2O + H2O. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 10) I. Trắc nghiệm: (6 điểm) Câu 1:Nguyên tử của nguyên tố X có cấu hình electron là :1s 22s22p63s23p6 3d74s2 . Trong bảng tuần hoàn X thuộc: A.Chu kì 4, nhóm IIA B. Chu kì 4, nhóm VIIIB C.Chu kì 4, nhóm VIIB D.Chu kì 4, nhóm IIB Câu 2:Thành phần của hạt nhân nguyên tử gồm: A.proton ,notron B. electron , notron , proton C. electron ,notron D. electron , proton Câu 3:Những ngtử nào sau đây là đồng vị của nhau ? 12 39 31 40 A. 12 B. 23 C . 30 D. 40 24 X; 25 Y 11 M; 19 U 15 Q ; 15 R 20 Z; 18 T Câu 4:Tổng số các hạt cơ bản trong ngtử của nguyên tố X là 46 , trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14 . Điện tích hạt nhân của X là : A. 16+ B. 15+ C. 14+ D. 31+ 2Câu 5:Ion X có 18e, hạt nhân nguyên tử có 16 nơtron. Số khối của nguyên tử X là : A. 34 B. 36 C. 30 D. 32 Câu 6:Dãy các nguyên tố được sắp xếp theo chiều tăng của tính kim loại là : A. Si, Al, Mg , Na , K B. Si , Al , Mg , K , Na C. Si , Mg , Al , Na, K D. Na , K , Si , Al , Mg Câu 7:Hợp chất khí với hidro của một nguyên tố là H 2R .Oxit cao nhất có chứa 40% về khối lượng nguyên tố R . Nguyên tử khối của R là : A. 14 B. 32 C. 31 D. 77 Câu 8:Nguyên tử hoặc ion chứa nhiều nơtron nhất là : 3+ 3+ A. 55 B. 57 C. 56 D. 58 25 Mn 26 Fe 26 Fe 28 Ni Câu 9:Hợp chất X tạo bởi ngtố A có Z=6 và nguyên tố B có Z=8 . Các loại liên kết có trong hợp chất X là : A. Cộng hóa trị phân cực B. Ion và cộng hóa trị C. Ion D. Cộng hóa trị có cực. Câu 10:Dãy các chất được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là: A. Cl2 , HCl , NaCl B. NaCl , Cl2 , HCl C. HCl , Cl2 ,NaCl D. Cl2 ,NaCl, HCl Câu 11:Cho p/ứ : H2S + 4Cl2 + H2O → H2SO4 +8HCl . Câu diễn tả đúng tính chất các chất p/ứ là : A. H2S là chất oxi hóa , Cl2 là chất khử B. Cl2 là chất oxi hóa ,H2S là chất khử C. Cl2 là chất oxi hóa ,H2O là chất khử D. H2O là chất oxi hóa ,Cl2 là chất khử Câu 12:Tổng hệ số nguyên tối giản của các chất trong p/ứ là: Mg + HNO 3 → Mg(NO 3)2 + N2O + H2O A. 23 B.24 C.25 D.26 Câu 13:P/ứ nào sau đây là p/ứ oxi hóa- khử ? A. P2O5 + H2O → H3PO4 B. Fe(OH)3 → Fe2O3 + H2O C. NO2 + KOH → KNO3 + KNO2 + H2O D. Mg(OH)2 + HNO3 → Mg(NO3)2 + H2O Câu 14: Hòa tan hoàn toàn 4,8g Mg vào dd HNO3 loãng dư, thu được dung dịch muối và V lít khí N2 ( đktc) duy nhất . Gía trị của V là :A. 4,48lít B. 0,448lít C. 8,96lít D. 0,896lít Câu 15:Qúa trình oxi hóa xảy ra trong p/ứ :Fe + CuSO4 FeSO4 + Cu là : A. Fe → Fe 2+ + 2e B. Fe + 2e → Fe 2+ C. Cu 2+ + 2e → Cu D. Cu 2+ → Cu +2e Câu 16: Cho phản ứng: a Al + b HNO 3 c Al(NO3)3 + d NH4NO3 + e H2O. Các hệ số a, b, c, d, e là những số nguyên đơn giản nhất. Tổng (c + e) bằng : A. 11 B. 23 C. 17 D. 12 Câu 17: Dãy hợp chất nào sau đây chỉ có liên kết ion : A. NaCl, CaO, MgCl2 B. KCl, HCl, CH4 C. NaBr, K2O, KNO3 D. MgO, HNO3, KHSO4 Câu 18: Nguyên tử của nguyên tố X có tổng số hạt là 40. Số khối của nguyên tử X là A. 29. B. 27 C. 28. D. 26. Câu 19: Trong hợp chất ion XY (X là kim loại, Y là phi kim), số electron của cation bằng số electron của anion và tổng số electron trong XY là 20. Biết trong mọi hợp chất, Y chỉ có một mức oxi hóa duy nhất. Công thức XY là A. AlN. B. LiF. C. MgO . D. NaF. + 6 Câu 20: Cation R có phân lớp ngoài cùng là 3p . Trong bảng tuần hoàn, nguyên tố R ở vị trí nào ? A. Ô 19, chu kì 4, nhóm IA B. Ô 17, ckì 3, nhóm VIIA C. Ô 18, c kì 3, nhóm VIIIA D. Ô 19, ckì 3, nhóm IA Câu 21: Cho 6,625g muối cacbonat A của kim loại kiềm phản ứng với 200 ml dung dịch HCl 2,19 % ( D = 1,25g/ml) thấy có bọt khí thoát ra. Biết lượng axit đã dùng dư 20% so với lượng cần thiết cho phản ứng. Công thức của A là: A. Li2CO3. B. Na2CO3. C. K2CO3. D. CaCO3. Câu 22: Công thức hidroxit cao nhất của R có dạng H 2RO4 thì công thức hợp chất khí với H của R có dạng: A. RH3 B. RH4 C. RH2 D. RH Câu 23: R thuộc chu kì 4, nhóm IIA. %O trong hidroxit cao nhất là: A. 21.62% B. 40% C. 43.24% D. 80% Câu 24: Có bao nhiêu câu không đúng trong các câu cho sau đây. (1) . X thuộc nhóm IIA, Y thuộc nhóm VA. Hợp chất tạo thành giữa X và Y là X5Y2. (2). Trong phân tử NH3 có 3 cặp electron chưa tham gia liên kết hóa học. (3). Trong bảng tuần hoàn gồm 3 chu kỳ lớn và 4 chu kì nhỏ. (4). Các nguyên tố trong cùng chu kỳ có số phân lớp bằng nhau. (5). Chỉ có một nguyên tố có tổng số electron ở phân lớp s bằng 7. A. 3 B. 2 C. 4 D. 5 II. Tự luận: Câu1: (2đ) Cân bằng các phản ứng oxi hóa- khử sau bằng phương pháp thăng bằng electron. a/ P + H2SO4 → H3PO4 + NO2 + H2O b/ FeCO3 + HNO3 → Fe(NO3)3 + NO + CO2+ H2O Câu 2:(2đ) Hòa tan hoàn toàn 23,4g kim loại A hóa trị I vào 227,2 gam nước thấy có 6,72 lít khí H 2 thoát ra ở đktc. a. Tìm nguyên tử khối của kim loại trên. b. Tính nồng độ % của chất tan trong dd thu được. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 10) I. Phần trắc nghiệm: 6 ĐIỂM Câu 1: Cho các phản ứng hóa học sau: 1. 4Na + O2 2Na2O 2. 2Fe(OH)3 t Fe2O3 + 3H2O 3. Cl2 + 2KBr 2KCl + Br2 4. NH3 + HCl NH4Cl 5. Cl2 + 2NaOH NaCl + NaClO + H2O Các phản ứng không phải phản ứng oxi hóa khử là A. 2, 4. B. 1, 2, 3. C. 2, 3 D. 4, 5 23 Na Câu 2: Nguyên tử 11 có số proton, electron và nơtron lần lượt là A. 11, 11, 12. B. 11, 12, 11. C. 11, 12, 13. D. 11, 11, 13. Câu 3: Số oxi hóa của nitơ trong NO2, HNO3, NO2- và NH4+ lần lượt là A. +4, +5, -3, +3. B. +4, +3, +5, -3. C. +4, +5, +3, -3. D. +3, +5, +3, -4. Câu 4: Xét phản ứng sau: 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O (1) 2NO2 + 2KOH KNO2 + KNO3 + H2O (2) Phản ứng (1), (2) thuộc loại phản ứng A. oxi hóa – khử nội phân tử. B. oxi hóa – khử nhiệt phân. C. tự oxi hóa khử. D. không oxi hóa – khử. Câu 5: Nguyên tố X có thứ tự là 20, vị trí của nguyên tố X trong bảng HTTH là: A. Chu kì 4, nhóm VIIIA. B. Chu kì 3, nhóm IIA. C. Chu kì 4, nhóm IIA. D. Chu kì 4, nhóm IIIA. Câu 6: Nguyên tố X có tổng số hạt (p, n, e) là 60, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 20. Cấu hình electron của nguyên tử X là A. 1s22s22p63s23p5 B. 1s22s22p63s23p63d104s1 C. 1s22s22p63s23p64s2 D. 1s22s22p63s23p63d104s24p5 Câu 7: Xét phản ứng MxOy + HNO3 M(NO3)3 + NO + H2O, điều kiện nào của x và y để phản ứng này là phản ứng oxi hóa khử ? A. x = y = 1. B. x = 2, y = 1. C. x = 2, y = 3. D. x = 1 hoặc 2, y = 1. Câu 8: Cặp chất chứa liên kết cộng hóa trị phân cực là A. Cl2 và HCl B. H2O và HCl C. N2 và Cl2 D. H2O và NaCl Câu 9: Trong phản ứng MnO2 + 4HCl MnCl2 + Cl2 + 2H2O, vai trò của HCl là A. oxi hóa. B. khử. C. tạo môi trường. D. khử và môi trường. Câu 10: X là nguyên tố thuộc nhóm IIA; Y là nguyên tố thuộc nhóm VIA. Hợp chất X và Y có công thức phân tử là A. XY2 B. X3Y C. XY. D. X2Y6 Câu 11: Hòa tan hoàn toàn 2,4g kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 duy nhất (đktc). Giá trị của V là A. 0,672 lít. B. 6,72lít. C. 0,448 lít. D. 4,48 lít. Câu 12: 1,84g hỗn hợp Cu và Fe hòa tan hết trong dung dịch HNO 3 tạo thành 0,01 mol NO và 0,04 mol NO2. số mol Fe và Cu theo thứ tự là : A. 0,02 và 0,03. B. 0,01 và 0,02. C. 0,01 và 0,03. D. 0,02 và 0,04. Câu 13: Nguyên tử của nguyên tố X có electron cuối cùng được điền vào phân lớp 4s 1. Nguyên tử của nguyên tố Y có electron cuối cùng được điền vào phân lớp 3p3. Số proton của X và Y lần lượt là A. 15 và 19 B. 19 và 15 C. 18 và 15 D. 19 và 14 Câu 14. Cho Mg + HNO3 → Mg(NO3)2 + N2 + H2O. Tỉ lệ số phân tử HNO3 đóng vai trò môi trường và bị khử là: A. 5:1 B. 1:5 C. 12:5 D. 12:5 Câu 15: Độ âm điện là đại lượng đặc trưng cho A. khả năng nhường electron cho nguyên tử khác. B. khả năng nhường proton cho nguyên tử khác. C. khả năng tham gia phản ứng mạnh hay yếu. D. khả năng hút electron của nguyên tử trong phân tử. o Câu 16: Cho 40g hỗn hợp ZnO, FeO, Fe2O3, Fe3O4, MgO tác dụng hết với 200ml dung dịch HCl 0,5M (vừa đủ) thu được dung dịch X. Khối lượng muối có trong X là A. 43,65 g. B. 50,90 g. C. 42,75 g. D. Kết quả khác. Câu 17: Cho 4,875 g một kim loại M hóa trị II tác dụng hết với dung dịch HNO 3 loãng thu được 1,12 lit khí NO duy nhất (đktc). Kim loại M là: A. Mg B. Zn C. Ni D. Cu Câu 18. Hòa tan m g Fe vào dung dịch HNO 3 loãng, dư thu được 0,448 lít khí NO duy nhất (đktc) và muối Fe(NO3)3. Giá trị của m là: A. 0,56 g B. 1,12 g C. 11,2 g D. 5,60 g Câu 19. Cho hỗn hợp gồm Fe và Al có khối lượng 19.3 gam tác dụng với dung dịch HCl dư thu được 14.56 lít khí H2 ( đktc). Tỉ lệ mol của Fe và Al là: A. 1:2 B. 1:3 C. 2:3 D. 3:2 Câu 20. Cho 3.6 gam Mg tác dụng với HNO3 thu khí NO. Số mol HNO3 đóng vai trò môi trường là: A. 0.4 B. 0.2 C.0.6 D. 0.3 Caâu 21 Nguyên tố X có 2 e cuối cùng điền vào phân lớp p. Trong công thức hợp chất khí với Hidro X chiếm 75% về khối lượng. Hỏi oxit cao nhất của X có liên kết thuộc loại gì? A. Liên kết cộng hóa trị không cực B. Liên kết ion C. Liên kết cho nhận D. Liên kết cộng hóa trị có cực Câu 22. Cho biết ion R2+ có cấu hình e ở phân lớp ngoài cùng là 3d8 . Chọn phát biểu đúng? A. Điện tích hạt nhân của M và M2+ bằng nhau và bằng 26+ B. Điện tích hạt nhân của M là 30+ và của M2+ là 28+ C. Điện tích hạt nhân của M và M2+ bằng nhau và bằng 28+ D. Điện tích hạt nhân của M là 28 + và của M2+ là 26+ Caâu 23. Cho nguyên tử lưu huỳnh ở ô thứ 16 . Cấu hình electron của S2- là: A. 1s22s22p6 B. 1s22s22p63s23p6 C. 1s22s22p63s2 D. 1s22s22p63s23p4 Caâu 24. Cho các nguyên tố 4Be, 11Na, 12Mg, 19K. Chiều giảm dần tính bazơ của các hydroxit là: A. Be(OH)2 < Mg(OH)2 < NaOH < KOH. B. Be(OH)2 > Mg(OH)2 > KOH > NaOH. C. Mg(OH) 2 > Be(OH)2 > NaOH > KOH D. KOH > NaOH > Mg(OH)2 > Be(OH)2. II. Phần tự luận: 4 ĐIỂM Câu 1( 2đ) Cân bằng các phương trình phản ứng hóa học theo phương pháp cân bằng electron. a. HCl + K2Cr2O7 KCl + CrCl3 + Cl2 + H2O. b. Cu + HNO3 Cu(NO3)2 + NO + H2O Câu 2. Cho 13,9g hỗn hợp gồm hai muối cacbonat của hai kim loại kiềm A, B ỏ 2 chu kì liên tiếp trong BTH tác dụng với HCl dư thì thu được 2,464 lít khí CO2 ( đktc). a. Xác định công thức của hai kim loại A và B. b. Tính khối lượng từng muối trong hỗn hợp ban đầu. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 11) I. Trắc nghiệm: (6đ) Câu 1 Thứ tự tăng dần độ âm điện nào sau đây là đúng: A. Al < Na < Mg < B < N < O. B. Na < Mg < Al < B < N < O C. Al < Mg< Na < B < O K > Mg > Al. B. K > Al > Mg > Na. C. K > Mg > Al > Na. D. K > Na > Mg > Al. Câu 3: Phản ứng nào sau đây không phải là phản ứng oxi hóa - khử ? A. 2HgO → 2Hg + O2 B. 2Fe(OH)3 → 2Fe2O3 + 3H2O. C. 2Na + H2O → 2NaOH + H2. D. 2Fe + 3Cl2 → 3FeCl3 Caâu 4 Caáu hình e cuûa nguyeân töû nhoâm Z = 13 laø 1s 22s22p63s23p1. Tìm caâu sai. A. Lôùp thöù 1 coù 2 e. B.Lôùp thöù 2 coù 8 e. C. Lôùp thöù 3 coù 3 D.Lôùp ngoaøi cuøng coù 1 e. Câu 5. Nguyên tử của nguyên tố nào sau đây chứa đồng thời 20n, 19e, 19p. 19 20 39 19 A. 20 X B. 19 B C. 19 Z D. 39T Caâu 6 Tìm caâu sai trong caùc caâu sau ñaây. A. Trong chu kì, caùc nguyeân toá ñöôïc xeáp theo chieàu ñieän tích haït nhaân taêng daàn B. Trong chu kì, caùc nguyeân toá ñöôïc xeáp theo chieàu khoái löôïng nguyeân töû taêng daàn C. Nguyeân töû cuûa caùc nguyeân toá trong cuøng 1 chu kì coù soá lôùp e baèng nhau D. Chu kì thöôøng baét ñaàu laø 1 kim loaïi kieàm, keát thuùc laø 1 khí hieám (tröø chu kì 1 vaø chu kì 7 chöa hoaøn thaønh) Câu 7 : Cho Fe có Z = 26. Cấu hình của ion Fe2+ là: A. 1s22s22p63s23p63d64s2 B. 1s22s22p63s23p64s23d4 2 2 6 2 6 5 1 C. 1s 2s 2p 3s 3p 3d 4s D. 1s22s22p63s23p63d6 Câu 8: X là nguyên tố thuộc nhóm VIIA. Công thức oxit cao nhất và hiđroxyt cao nhất của X là công thức nào sau đây? A. X2O7 , X(OH)4 B. X2O , H2XO4, C. X2O7 , HXO4 D. X2O, HXO4 Câu 9: Nguyên tố R có CT oxit cao nhất là RO2. Công thúc hợp chất khí của R với hidro là: A.RH3 B. RH2 C.RH5 D.RH4 Câu 10: Nguyên tử của nguyên tố A có cấu hình elctrron ở phân lớp ngoài cùng là 4s 1. Số hiệu nguyên tử của A là A. 26 B. 6 C. 20 D. 24 Câu 11: Cho phản ứng sau:H2S + KMnO4 + H2SO4 loãng –> H2O + S + MnSO4 + K2SO4 Hệ số các chất tham gia trong PTHH của phản ứng trên là: A. 3, 2, 5 B. 5,2,3 C. 2,2,5 D. 5,2,4 Caâu 12. Cho 4 n.toá: Mg, B, Na, Be. Xaép xeáp theo chieàu taêng daàn baùn kính n.töû naøo cuûa caùc n.toá naøo sau ñaây laø ñuùng: A. B < Na < Be < Mg. B. B < Be< Mg < Na. C. Na < Be< B B. Cl2 Không là chất oxi hoá, không là chất khử. C. Cl2 Chỉ là chất oxi hoá . D. Cl2 Chỉ là chất khử Câu 18: Hãy chọn phản ứng mà SO2 có tính oxi hoá : A. 5SO2 + 2KMnO4 + 2H2O K2SO4 + 2MnSO4 + 2H2SO4 B. SO2 + Na2O Na2SO3 C. SO2 + 2H2O + Br2 2HBr + H2SO4 D. SO2 + 2H2S 3S + 2H2O Câu 19: Cho các phản ứng hóa học sau: 1. 4Na + O2 2Na2O 2. 2Fe(OH)3 t Fe2O3 + 3H2O 3. Cl2 + 2KBr 2KCl + Br2 4. NH3 + HCl NH4Cl 5. Cl2 + 2NaOH NaCl + NaClO + H2O Các phản ứng không phải phản ứng oxi hóa khử là A. 2, 4. B. 1, 2, 3. C. 2, 3 D. 4, 5 Câu 20: Cho các phân tử : H2, N2, HCl, Cl2, CH4. Có bao nhiêu phân tử không cực ? A.1 B.2 C.3 D. 4 o Câu 21: Dãy gồm các chất mà phân tử có liên kết cộng hóa trị là: A. NaOH; HCl, MgO B. CO2; HCl, H2O. C. H2CO3, CaO; HF. D. Na2SO4; KBr; SO2. Caâu 22: Nguyên tố X có công thức của hợp chất khí với H là XH 3 , trong oxit cao nhất của X có 25,93% khối lượng của X. Tìm nguyên tố X và viết công thức hidroxit tương ứng. (cho P = 31, Si = 28, N = 14, C = 12, Cl = 35,5) A. C B. N C. P D. S Caâu 23: Đốt thanh kim loại nhóm IIA có khối lượng 19,5 gam trong bình kín chứa oxi đến khi thanh kim loại có khối lượng 22,7 gam. Thể tích khí oxi cần dùng (đktc) là: A. 1,12 lit B. 3,36 lit C. 6,72 lit D. 2,24 lit Caâu 24: Hòa tan 4 gam hỗn hợp gồm Fe và một kim loại R thuộc nhóm IIA vào dung dịch HCl dư thì thu được 2,24 lít khí H2 (đktc). Nếu chỉ dùng 2,4 gam kim loại R cho vào dung dịch HCl thì dùng không hết 0,3 lit dung dịch HCl 1M. R là kim loại: A. Ca (M=40) B. Ba (M=137) C. Mg (M=24) D. Be (M=9) II. Tự luận: (4đ) Câu 1: cân bằng các pt sau, xác định chất khử, chất oxi hóa 1. P + H2 SO4 → H3PO4 + SO2 +H2O. 2. KMnO4 + Zn + H2SO4 → MnSO4 + ZnSO4 + K2SO4 + H2O Câu 2: (2đ) Hòa tan hoàn toàn 6,2 gam hỗn hợp hai kim loại A, B thuộc nhóm IA và thuộc hai chu kì liên tiếp nhau trong bảng tuần hoàn vào dung dịch HCl vừa đủ thoát ra 2,24 lít khí H2 ( đktc). a) Xác định tên hai kim loại A, B. b) Tính khối lượng mỗi kim loại trong hỗn hợp. (Cho Li =7, Na =23, K =39, Rb =86 ) ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 12) A. Phần trắc nghiệm: ( 6 điểm – gồm 24 câu trắc nghiệm) Câu 1. Ion X2+ có cấu hình electron là 1s 22s22p6. Tổng số electron s của X và tổng số electron s của Y hơn kém nhau 1. Số nguyên tố tố Y thỏa mãn điều kiện trên là: A. 1 B. 2 C. 3 D. 4 Câu 2. Cho các nhận định sau: (1). Đồng vị là những nguyên tố có cùng số p khác số n. (2). Đơteri, Triti, Proti là 3 đồng vị của Hidro, Đồng vị nặng nhất của Hidro là Đơteri. (3). Điện tích của electron có giá trị: qe = 1,602.10-19 culong. (4). Trong một nguyên tử bất kì phải có đủ thành phần electron, proton, notron. (5). Đường kính của nguyên tử lớn hơn đường kính của hạt nhân vào khoảng 20000 lần. Số nhận định không đúng là: A. 2 B. 3 C. 4 D. 5 Câu 3. Ở 200C DAu = 19,32 g/cm3. Giả thiết trong tinh thể các nguyên tử Au là những hình cầu chiếm 75% thể tích tinh thể. Biết khối lượng nguyên tử của Au là 196,97. Tính bán kính nguyên tử của Au? A.1.52.10-8cm B. 1.45.10-8cm C. 2.52.10-8cm D. 1.02.108 cm 63 65 65 63 Câu 4. Cu có hai đồng vị bền 29 Cu và 29 Cu . Trong đó 29 Cu chiếm 27%. Tìm khối lượng của 29 Cu có trong 250 gam CuSO4 ( cho biết MO = 16, MS= 32) A. 72.08 gam B. 60.45 gam C. 78.15 gam D. 61.52 gam Câu 5. Nguyên tử X có 5 ep ở lớp M, số hạt mang điện tích của ion X- là: A. 9 B. 18 C. 19 D. 17 Câu 6. Hòa tan hoàn toàn một kim loại A ( hóa trị II) trong dung dịch HCl 21.9% ( vừa đủ) thì thu được dung dịch mới có nồng độ 32.79%. Kim loại A là: A. Mg B. Fe C. Ca D. Zn Câu 7. Chọn câu đúng: A. Trong chu kỳ theo chiều giảm dần điện tích hạt nhân, bán kính nguyên tử giảm dần. B. Trong một nhóm, tính kim loại giảm dần theo chiều tăng của độ âm điện. C. Trong một nhóm, bán kính nguyên tử giảm dần tính kim loại tăng dần. D. trong một chu kỳ, tính phi kim tăng dần theo chiều giảm của độ âm điện. Câu 8. Cho các nhận định sau đây: (1). Trong cùng Chu kì , theo chiều tăng ĐTHN , bán kính nguyên tử giảm, tính phi kim tăng. (2). Trong cùng nhóm chính, theo chiều tăng tính kim loại độ âm điện của nguyên tố giảm. (3). Trong một nhóm chính, theo chiều tăng BKNT , khả năng nhường electron tăng dần. (4). Trong chu kì, hóa trị cùa nguyên tố trong hợp chất khí với hidro giảm dần từ 4 đến 1. (5). Trong chu kì hóa trị của các nguyên tố trong oxit cao nhất biển đổi tuần hoàn từ 1 đến 7. (6). Trong một nhóm chính, tính KL tăng dần đông thời tính PK giảm dần theo chiều tăng ĐTHN Số nhận định đúng là: A. 3 B. 4 C. 5 D. 6 Câu 9. Chọn câu đúng: A. Số TT nhóm bằng số electron lớp ngoài cùng. C. Số chu kì nhỏ và chu kì lớn trong BTH lần lượt là 3 và 4 B. Số nguyên tố thuộc chu kì 2 và chu kì 4 lần lượt là 2 và 8. D. Liên kết trong phân tử KCl là liên kết cộng hóa trị có cực. Câu 10. Ion X2- có cấu hình e lớp ngoài cùng là: 3s 23p6. %X trong hidroxit cao nhất tương ứng của X là: A. 32.65% B. 40% C. 60% D. 37.35% Câu 11. Cho các phân tử : H2, CO2, Cl2, N2, I2, C2H4, C2H2. Bao nhiêu phân tử có lk kết ba trong phân tử ? A.1 B. 2 C. 3 D.4 Câu 12. A thuộc nhóm IIA, B thuộc nhóm VA. Hợp chất tạo thành giữa A và B là: A. A5B2 B. AB C. A3B2 D. A2B3. Câu 13. A là hợp chất của C và H. Tỉ khối của A đối với O2 là 1.3125. Công thức phân tử của A là: A. C3H6 B. C2H6 C. C3H8 D. C5H10. Câu 14. Phân tử nào sau đây mà số cặp electron chưa tham gia liên kết là 4: A. HCl B. N2 C. CO2 D. H2O. Câu 15. Số oxi hóa của S trong các hợp chất đơn chất Na2S, S, Na2SO4 và K2SO3 lần lượt là: A. -2, 0, +4, +6 B. -2, 0, +6, +4. C. +4, -2, 0, +6 D. -2, +4, 0, +6. Câu 16. Cho phản ứng sau: CuCl2 + 2AgNO3 Cu(NO3)2 + 2AgCl thuộc kiểu phản ứng: A. Thế B. Kết hợp C. Trao đổi D. Phân hủy. Câu 17. Phản ứng nào sau đây chứng tở HNO3 bị khử mạnh nhất. A.Fe + HNO3 Fe(NO3)3 + NO + H2O. C. Mg + HNO3 Mg(NO3)2 + N2 + H2O. B. Al + HNO3 Al(NO3)3 + NH4NO3 + H2O. D. Cu + HNO3 Cu(NO3)2 + NO2 + H2O. Câu 18. Tổng hệ số cân bằng của phản ứng FeS2 + O2 Fe2O3 + SO2. A. 25 B. 30 C. 32 D. 35. Câu 19. Cho 5,4 gam Al tác dụng với H 2SO4 đặc, nóng thoát ra 6,72 lít khí X ( đktc) . Tổng hệ số cân bằng của phản ứng là: A. 18 B. 20 C. 11 D. 15 Câu 20. Cho Al + HNO3 thu được hỗn hợp hai khí N2 và NO tỉ lệ mol 1:1. Tổng hệ số cân bằng của phản ứng là: A. 63 B, 104 C.102 D. 98 Câu 21. Cho 8,3 gam Al và Fe tác dụng với HNO 3 thu được 13.44 lít khí NO2 ( đktc). Xác định %Al trong hỗn hợp. A. 35.5% B. 32.53% C. 67.17% D. 56.15% Câu 22:Hoà tan m gam Al vào dung dịch HNO 3 rất loãng chỉ thu được hỗn hợp khí gồm 0,03mol N2O và 0,01 mol NO . Giá trị m là A. 8,1 gam B. 13,5 gam C. 2,43 gam D. 1,35 gam Câu 23. Đốt cháy hoàn toàn hỗn hợp FeS , FeS 2 , CuS2 , Cu2S với tỉ lệ mol như nhau và có tổng khối lượng là 9.92 trong oxi (dư) thu được Fe2O3 và SO2 gam thì tổng số mol electron đã nhường là: A. 0.72 mol B. 0.58 mol C. 0.84 mol D. 0.96 mol Câu 24. Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe 2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dịch HNO 3 dư, thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất và dung dịch X gồm Fe(NO3)3 và HNO3 dư. Giá trị của m là A. 11,2 gam. B. 10,2 gam. C. 7,2 gam. D. 6,9 gam. B. Phần tự luận: Câu 1. Cân bằng phương trình phản ứng hóa học sau theo phương pháp cân bằng electron: a). Ca3(PO4)2 + C + SiO2 CaSiO3 + P + CO b). Mg + H2SO4 MgSO4 + H2S + H2O. Câu 2. Hòa tan hoàn toàn 9,6 gam oxit của kim loại ( trong đó % = 30%) vào 76,65 gam dung dịch HCl 20%. a. Xác định công thức oxit kim loại. b. Tính C% của dung dịch tạo thành sau phản ứng. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 13) I. Trắc nghiệm: (6đ) Câu 1: Trong nguyên tử một nguyên tố A có tổng số các loại hạt là 34. Biết số hạt p ít hơn số hạt n là 1 hạt. Số p, n, e trong nguyên tử A lần lượt là A. 11, 12, 11. B. 12, 11, 11. C. 12, 11, 12. D. 11, 12, 12. Câu 2: Trong các chất sau: NaCl, H2O, MgS, NH3, Al2O3. Các chất chỉ có liên kết ion là: A. H2O, MgS. B. H2O, NH3. C. NaCl, Al2O3 D. NaCl, H2O. Câu 3: Phát biểu không đúng là A. Sự khử là sự mất electron. B. Chất khử là chất nhường electron. C. Chất oxi hóa là chất thu electron. D. Sự oxi hóa là sự mất electron. Câu 4: X là nguyên tử có chứa 20 proton, Y là nguyên tử có chứa 17 electron. Công thức hợp chất được hình thành giữa hai nguyên tử X và Y là A. XY2 với liên kết ion. B. X2Y với liên kết cộng hóa trị. C. XY với liên kết ion. D. X3Y2 với liên kết cộng hóa trị. Câu 5: 1.( Z = 15). Chu kỳ 3, nhóm VA. 2. (Z = 17). Chu kỳ 3, nhóm VIIA 3.(Z = 23). Chu kỳ 4, nhóm VB. 4. (Z = 19). Chu kỳ 3, nhóm IB. 5.Z = 27). Chu kỳ 4, nhóm VIIB. 6. (Z = 35). Chu kỳ 4, nhóm VIIA. Vị trí ứng đúng với Z là A. (1, 2, 4, 6). B. (1, 3, 4, 6). C. (1, 2, 3, 6). D. ( 1, 2, 5, 6). Câu 6: Đtích của các hạt electron và hạt nơtron trong các ngtử được quy ước lần lượt là: A. -1, 0. B. 1- , 1+. C. 1+, 0. D. 1- , 0. Câu 7: Cation X2+ có cấu hình e: 1s22s22p6, vị trí của X trong bảng tuần hoàn là: A. Chu kỳ 3, nhóm IIA. B. Chu kỳ 2, nhóm VIA. C. Chu kỳ 2, nhóm VIIIA. D. Chu kỳ 3, nhóm VIIIA. Câu 8: Cho X (20 p, 20 n ) ; Y(18 p , 22 n ) ; Z ( 20 p , 22 n). Các đồng vị của cùng ngtố là: A. Z , Y , X. B. Z , Y. C. X , Y D. X , Z. Câu 9: Cho sơ đồ phản ứng: KMnO4 + KI + H2SO4 K2SO4 + MnSO4 + I2 + H2O. Hệ số cân bằng của các chất phản ứng lần lượt là: A. 2, 8, 6. B. 3,7,5. C. 2, 10, 8. D. 4, 5, 8. Câu 10: Phân lớp d chứa tối đa số electron là A. 10 B. 6 C. 8 D. 2. Câu 11: Thành phần % về khối lượng của nguyên tố kali trong hợp chất K2SO4 là A. 22,41 %. B. 44,83%. C. 45,88%. D. 57,78%. Câu 12: Nguyên tử của nguyên tố chứa đồng thời 20n, 19e, 19p là A. 19 B. 1939T C. 20 D. 39 20 X 19 B 19 Z Câu 13: Thứ tự tăng dần độ âm điện nào sau đây là đúng: A. Na < Mg < Al < B < N < O. B. O < N < Mg < Na < Al < B. C. Al < Mg< Na < B < O C. +2, +3, +4, 0. D. +3, +2, + ; 0. Câu 15: Liên kết giữa Si và H là : ( biết Si = 1,9 ; H = 2,2) A. liên kết cộng hóa trị không phân cực. B. liên kết cộng hóa trị có phân cực. C. liên kết đơn. D. liên kết ion. Câu 16: Cho 8,1g Al vào dung dịch H2SO4 đặc, nóng dư thu được V(l) SO2(đktc) (sản phẩm khử duy nhất). Giá trị của V là A. 20,16. B. 6,72. C. 10,08. D. 3,36. Câu 17: Cho 19,5g kim loại nhóm IA vào nước thu được 0,25 mol H2. Kim loại đó là A. K. B. Na. C. Cs. D. Li. Câu 18: Cặp chất chứa liên kết cộng hóa trị phân cực là A. H2O và NaCl. B. N2 và Cl2. C. Cl2 và HCl. D. H2O và HCl. Câu 19: Cho phản ứng sau: CuCl2 + 2AgNO3 Cu(NO3)2 + 2AgCl thuộc kiểu phản ứng: A. Trao đổi. B. Thế. C. Kết hợp. D. Phân hủy. Câu 20: Phản ứng nào sau đây N trong HNO3 bị khử về số oxi hóa thấp nhất. A. Cu + HNO3 Cu(NO3)2 + NO2 + H2O. B. Mg + HNO3 Mg(NO3)2 + N2 + H2O. C. Fe + HNO3 Fe(NO3)3 + NO + H2O. D. Al+HNO3 Al(NO3)3+NH4NO3 + H2O Câu 21: Hoà tan 8,3 gam hỗn hợp gồm Na và Ca trong 500ml dd HC l,4M thu được dd A và 4,48 lít khí H2 ở điều kiện tiêu chuẩn. Phần trăm số mol kim loại Ca trong hỗn hợp là : A. 60% B. 50% C. 40% D. 30% Câu22: Hỗn hợp X gồm hai kim loại A, B ở 2 chu kỳ liên tiếp ở phân nhóm chính nhóm II. Lấy 0,88g X cho tan hoàn toàn trong dd HCl dư thấy tạo ra 672 ml H 2 (đktc). Cô cạn dd thu được m gam muối khan. Giá trị của m là A. 3,01g B. 1,945g C. 2,995g D. 2,84g Câu 23: Hoà tan hoàn toàn 19,5 gam Kali kim loại vào 381 gam nước thu được dung dịch A. Nồng độ % của chất tan trong dung dịch A là: A. 7% B. 4,875% C. 7,35% D. 5,12% Câu 24: Một nguyên tố R có hoá trị trong oxit cao nhất bằng hoá trị trong hợp chất khí với hiđro. Phân tử khối của oxit này bằng 1,875 lần phân tử khối của hợp chất khí với hiđro. N guyên tố R là A. N B. C C. Si D. S II. Tự luận: (4đ) Câu 1: (2đ) Xác định chất khử, chất oxi hóa, và cân bằng phương trình phản ứng theo phương pháp cân bằng electron: a. K2MnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O b. MnO2 + HCl MnCl2 + Cl2 + H2O Câu 2: (2đ) Hòa tan hoàn toàn 6,4 gam hỗn hợp gồm hai kim loại A, B thuộc nhóm IIA và thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào dung dịch HCl vừa đủ thu được 4,48 lít khí H2 ( đktc). a) Xác định hai kim loại A, B. b) Tính khối lượng mỗi kim loại trong hỗn hợp. (Cho Be =9, Mg =24, Ca =40, Sr =88) ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 14) A. Phần trắc nghiệm: Caâu 1. Cation X2+ có cấu hình e: 1s22s22p6, vị trí của X trong bảng tuần hoàn là: A. Chu kỳ 3, nhóm IIA. B. Chu kỳ 2, nhóm VIA. C. Chu kỳ 3, nhóm VIIIA D. Chu kỳ 2, nhóm VIIIA. Caâu 2. 1.( Z = 15). Chu kỳ 3, nhóm VA. 2. (Z = 17). Chu kỳ 3, nhóm VIIA 3.(Z = 23). Chu kỳ 4, nhóm VB. 4. (Z = 19). Chu kỳ 3, nhóm IB. 5.Z = 27). Chu kỳ 4, nhóm VIIB. 6. (Z = 35). Chu kỳ 4, nhóm VIIA. Vị trí ứng đúng với Z là A. (1, 2, 3, 6). B. (1, 2, 4, 6). C. (1, 3, 4, 6). D. ( 1, 2, 5, 6). Caâu 3. Thứ tự tăng dần độ âm điện nào sau đây là đúng: A. Na < Mg < Al < B < N < O. B. O < N < Mg < Na < Al < B. C. Al < Mg< Na < B < O 66 thành phần phần trăm về số nguyên tử của các đồng vị 30 Zn và 30 Zn lần lượt là: A. 41% và 59% B. 59% và 41% C. 65% và 35% D. 65% và 41% Câu 14: Chọn câu không đúng : A. Chất ôxi hóa là chất nhận electron và số oxi hóa giảm sau phản ứng. B. Cho các nguyên tố sau: 12X, 11Y, 13Z. Sắp xếp theo chiều tăng dần tính kim loại là: Y < X < Z C. Nguyên tử của nguyên tố có cấu hình electron lớp ngoài cùng là 4s1 là: K, Cu và Cr. D. Trong phản ứng: Cl2 + KOH KCl + KClO3 + H2O Tỉ lệ giữa số nguyên tử clo đóng vai trò chất oxi hóa và số nguyên tủ clo đóng vai trò chất khử là 1:5 Câu 15. Nung 14,6 g hỗn hợp kim loại Al, Zn, Mg trong oxi dư thu được m gam oxit. Để hòa tan hết m gam hỗn hợp oxit này cần 650 ml dung dịch H2SO4 1M. Giá trị m là: A. 25.0 g B. 17,2 g C. 35.4 g D. 45,6 g Câu 16. Cho 4,6 gam KL R ở nhóm IA tdụng với nước thì thu được 1.321 lít khí H2 (đktc). R là: A. Li B. Rb C. K D. Na Câu 17. Ion X3- có cấu hình electron lớp ngoài cùng là: 3s23p6. %X trong hidroxit cao nhất tương ứng của X là: A. 32.65% B. 31.63% C. 60% D. 37.35% Câu 18. Cho 13.32 gam hỗn hợp gồm hai muối cacbonat A2CO3 và BCO3 tác dụng với dung dịch HCl dư thu được 14.64 gam muối clorua khan và V lít khí ( đktc). Giá trị của V là: A. 1.344 lít B. 1.792 lít C. 1.586 lít D. 2.688 lít Câu 19. Cho 43.2 gam hỗn hợp gồm Al, Zn, Fe hòa tan hoàn toàn vào dung dịch HCl vừa đủ thì thấy khối lượng của dung dịch tăng thêm 41.3 gam. Tính khối lượng dung dịch HCl nếu biết Nồng độ C% = 25%. A. 146 gam B. 292 gam C. 54.8 gam D. 277,4 gam. Câu 20. Hòa tan hết 108g FeO vào dung dịch HNO3 thì thấy có khí V (lít) khí NO duy nhất thoát ra ở đktc. Tính V? A. 33,6 B. 22,4 C. 44,8 D. 11,2 Caâu 21. Khi cho 2,46 gam hỗn hợp Cu và Al tác dụng với dung dịch HNO 3 đặc, dư, đun nóng, sinh ra 2,688 lít khí duy nhất NO2 (đktc). % khối lượng của Cu và Al trong hỗn hợp lần lượt là : A. 21,95 % Cu và 78,05 % Al. B. 78,05 % Cu và 21,95 % Al C. 38,8 % Cu và 61,2 % Al. D. 61,2 % Cu và 38,8 % Al. Câu 22. Nếu hòa tan 5,22 gam hỗn hợp gồm Zn và mọt kim loại X ( hóa trị II) trong dung dịch HCl (dư) thì thoát ra 2.016 lít khí H2 (dktc). Mặc khác nếu lấy 5.5 gam kim loại X tác dụng với 240 ml dung dịch HCl thì thấy axit vẫn còn dư. Kim loại X là 1 trong 4 kim loại nào cho sau đây: A. Ca B. Ni C. Ba D. Fe Câu 23. X là nguyên tố phi kim thuộc chu kì 2 và có công thức oxit cao nhất là XO 2. Hợp chất tạo bởi X và Y có công thức Y4X3 , biết X chiếm 25% theo khối lượng . Y là nguyên tố : A. Fe B. B C. Al D. Ga Câu 24. Đốt cháy hỗn hợp 8.86 gam hỗn hợp gồm Cu, Fe, Al trong oxi , sau một thời gian thu được 12,06 gam chất rắn. Tính thể tích khí O2 ( đktc) đã tham gia phản ứng. A. 2.24 lít B. 4.48 lít C. 1.12 lít D. 3.36 lít II. Phần tự luận: Câu 1. Cân bằng các phương trình phản ứn sau theo phương pháp cân bằng electron: a).Cr2O3 + KNO3 + KOH K2CrO4 + KNO2 + H2O b) KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O Câu 2. Hòa tan31.1 gam hỗn hợp hai muối cacbonat của hai kim loại thuộc nhóm IA ( thuộc hai chu kì liên tiếp nhau trong bảng tuần hoàn) vào dung dịch H2SO4 vừa đủ thoát ra V lít khí ( đktc) và dung dịch có khối lượng tăng thêm 10.3 gam. a. Xác định công thức của hai muối ban đầu. b. Tính C% của các chất trong dung dịch Y. ĐỀ ÔN TẬP HỌC KÌ 1 ( ĐỀ SỐ 15) A. Phần trắc nghiệm: Caâu 1. Hai nguyên tử của cùng một nguyên tố thì phải có cùng tính chất nào sau đây: A. Cùng số khối. B. Cùng số prôtôn C. Cùng số nơtron và số khối . D. Cùng số nơtron. Caâu 2. Ion X2- có 18e, hạt nhân nguyên tử có 16 nơtron. Số khối của nguyên tử X là : A. 34 B. 36 C. 32 D. 30 Caâu 3. R2+ có cấu hình electron là 2s22p6. Hiệu số electron s của R và X là 1. Số nguyên tố X thõa mãn điều kiện trên A. 1 B. 3 C. 4 D. 2 Caâu 4. Có bao nhiêu câu không đúng trong các câu cho sau đây. (1) . X thuộc nhóm IIA, Y thuộc nhóm VA. Hợp chất tạo thành giữa X và Y là X5Y2. (2). Trong phân tử NH3 có 3 cặp electron chưa tham gia liên kết hóa học. (3). Trong bảng tuần hoàn gồm 3 chu kỳ lớn và 4 chu kì nhỏ. (4). Các nguyên tố trong cùng chu kỳ có số phân lớp bằng nhau. (5). Chỉ có một nguyên tố có tổng số electron ở phân lớp s bằng 7. A. 3 B. 2 C. 4 D. 5 to Caâu 5. Cho các phản ứng hóa học sau: 1. 4Na + O2 2Na2O 2. 2Fe(OH)3 Fe O 2 3 + 3H2O 3. Cl2 + 2KBr 2KCl + Br2 4. NH3 + HCl NH4Cl 5. Cl2 + 2NaOH NaCl + NaClO + H2O Các phản ứng không phải phản ứng oxi hóa khử là A. 1, 2, 3. B. 2, 4. C. 2, 3 D. 4, 5 Caâu 6. Oxit cao nhất của nguyên tố R ứng với công thức RO2 . Trong hợp chất của R với hidro có 75%R và 25% H. Nguyên tố R đó là : A. Cacbon. B. Magie. C. Nitơ. D. Photpho. Caâu 7. KMnO4 + FeSO4 + H2SO4 Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là A. 5 và 2. B. 2 và 5. C. 5 và 1. D. 2 và 10 2+ Caâu 8. Cho phản ứng: Zn + CuCl2 ZnCl2+ Cu. Trong phản ứng này, 1 mol Cu A. đã nhận 1 mol electron. B. đã nhường 1 mol electron. C. đã nhường 2 mol electron. D. đã nhận 2 mol electron. Caâu 9. Tính phi kim của các halogen giảm dần theo thứ tự: A. F, I, Cl, Br B. F, Br, Cl, I C. F, Cl, Br, I D. I, Br, Cl, F Caâu 10. Tổng hạt mang điện tích âm trong ion NO3- là: A. 32 B. 33 C. 31 D. 30 Câu 11. X và Y là hai kim loại kiềm ( liên tiếp nhau) có khối luộng 10,1 gam tác dụng hết nước thoát ra 3,36 lít khí ( đktc). Xác định lệ mol X và Y. ( MX < MY) A. 2:3 B. 1:2 C. 2:1 D/ 1:1 Câu 12:Hoà tan m gam Al vào dung dịch HNO 3 rất loãng chỉ thu được hỗn hợp khí gồm 0,03mol N 2O và 0,01 mol NO . Giá trị m là A. 8,1 gam B. 13,5 gam C. 2,43 gam D. 1,35 gam Câu 13. Cho 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột tác dụng hoàn toàn với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,73 gam. Thể tích dung dịch HCl 2M vừa đủ để phản ứng hết với Y là: A. 20 ml. B. 50 ml. C. 100 ml. D. 90 ml. Câu 14. Cho phản ứng : Na + Cl2 → 2NaCl ∆ H = -882,2 kj Đây là phản ứng: A. Thu nhiệt B. tỏa nhiệt. C. không thu nhiệt. D. trao đổi. Câu 15. Coù bao nhieâu phaûn öùng oxi hoùa khöû trong caùc phaûn öùng cho sau ñaây: 1. CaO + CO CO2. 2. CuO + CO Cu + CO2. 2 3. Fe(OH)2 + O2 + H2O Fe(OH)3. 4. NaAlO2 + CO2 + H2O Al(OH)3 + NaHCO3. 5. NH3 + H2SO (NH4)2SO4. 6. NaHSO4 + NaHCO Na2SO4 + CO2 + H2O. 4 3 7. FeCl3 + KI FeCl2 + KCl + I2. 8. FeCl3 + SnCl FeCl2 + SnCl4. 2 A. 3 B. 4 C. 5 D.6 Câu 16: Cho các phương trình phản ứng sau : a)SO2 + Cl2 + 2H2O H2SO4 +2 HCl b) 2NO2+ 2NaOH NaNO2 + NaNO3 + H2O c)CO2 + NaOH NaHCO3 d)Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O e)3Fe3O4 +28HNO3 9Fe(NO3)3+NO + 14H2O f) Fe2O3 + 6HNO3 2Fe(NO3)3 + 3H2O g)AgNO3 + Fe(NO3)2 Fe(NO3)3 + Ag h)C2H6 + Cl2 C2H5Cl + HCl i)CH3CH2OH + CuO CH3CHO + Cu + H2O k)Fe + 2Fe(NO3)3 3Fe(NO3)2 . Số phản ứng oxi hoá khử là : A.6 B. 7 C.8 D.9 65 63 Câu 17. Đồng có 2 đồng vị bền 29 Cu và 29 Cu . Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm số nguyên tử của đồng vị đồng có số khối 63. A. 27% B. 73% C. 26,5% D. 73.5% Câu 18. Kim loại A có khối lượng 2.352 gam tác dụng với Oxi tạo ra oxit có khối lượng 3.248 gam oxit. Kim loại A là: A. Al B. Fe C. Cu D. Mg Câu 19. Cho 6C, 16S, 11Na, 12Mg. Dãy có chiều giảm tính bazơ và tăng tính axit của các oxit là: A. Na2O , MgO , CO2 , SO3. B. MgO , Na2O , SO3 , CO2. C. Na2O , MgO , SO3 , CO2. D. MgO , Na2O , CO2 , SO3. Câu 20. Ñeå m gam boät saét ngoaøi khoâng khí moät thôøi gian thu ñöôïc 6 gam hoãn hôïp caùc chaát raén . Hoaø tan hoaøn toaøn hoãn hôïp ñoù baèng dung dòch HNO 3 loaõng thu ñöôïc 1,12 lít khí NO duy nhaát (ñktc) và muối Fe(NO3)3. Tìm m? A. 5.04 gam B. 4.48 gam C. 5.6 gam D. 8.4 gam. Câu 21.Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. Nguyên tố R và vị trí của nó trong bảng HTTH là A. Na ở ô 11, chu kỳ III, nhóm IA. B. Mg ở ô 12, chu kỳ III, nhóm IIA. C. F ở ô 9, chu kỳ II, nhóm VIIA. D. Ne ở ô 10, chu kỳ II, nhóm VIIIA. Câu 22. Cho 0.972 gam Al tác dụng với H2SO4 đặc thì thu được 0.3024 lít khí X. Phản ứng hóa học tổng hệ số của các chất tham gia phản ứng là: .A. 19 B. 23 C. 42 D. 45 Câu 23. Hòa tan m gam Fe vào dung dịch HNO3 loãng dư thu được khí N2. Khối lượng dung dịch sau phản ứng đã tăng 14.28 gam so với khối lượng dung dịch ban đầu, thể tích khí N2 ( đktc). A. 1.568 B. 1.792 C. 1.344 D. 2.016 Câu 24. Hòa tan hoàn toàn 3.37 gam hỗn hợp Cu, Fe, Mg, Al trong dung dịch HNO 3 dư thu được m gam hỗn hợp các muối sau: Cu(NO3)2, Fe (NO3)3, Mg(NO3)2, Al(NO3)3 và 616 ml khí N2O ( đktc). Giá trị m là: A. 6.48 gam B. 14.33 gam C. 16.56 gam D. 17.01 gam B. Phần tự luận: Câu 1. Cân bằng các phương trình phản ứng sau theo phương pháp cân bằng electron. a) KMnO4 + H2O2 → MnO2 + O2 + KOH + H2O b) SO2 + KMnO4 + H2O → H2SO4 + MnSO4 + K2SO4 Câu 2. Hòa tan hoàn toàn 7,04 gam hỗn hợp hai muối cacbonat của hai kim loại nhóm IIA liên tiếp nhau vào dung dịch HCl 18% thu được 3.52 gam CO2. a. Tìm công thức hai muối và tính khối lượng từng muối trong hỗn hợp ban đầu. b. Tính nồng độ C% của dung dịch sau phản ứng biết lượng axit đã dùng dư 20% so với lượng cần phản ứng. Page 2We are a group of students working on this project as if it were a full time job. Any amount will help support and continue the development of this project and will be greatly appreciated. |